A Química Inorgânica é uma das grandes áreas da Química, responsável por estudar as propriedades, estruturas, composição e reatividade de compostos de origem mineral. Os compostos inorgânicos são classificados em quatro funções principais: ácidos, bases, sais e óxidos. Cada uma dessas funções desempenha um papel importante tanto em fenômenos naturais quanto em processos industriais.
A Química Inorgânica está intimamente ligada ao desenvolvimento tecnológico e ao bem-estar humano. Ela contribui para a criação de medicamentos e equipamentos médicos, na compreensão e controle de fenômenos como a chuva ácida e a poluição do solo e na fabricação de materiais como ligas metálicas, pigmentos, fertilizantes e catalisadores. Além disso, avanços na Química Inorgânica têm possibilitado o desenvolvimento de tecnologias sustentáveis, como a purificação de água e a captura de gases do efeito estufa.
Leia também: Quais são as reações orgânicas?
Tópicos deste artigo
- 1 - Resumo sobre Química Inorgânica
- 2 - O que é Química Inorgânica?
- 3 - O que se estuda em Química Inorgânica?
- 4 - Funções inorgânicas
- 5 - O que são substâncias inorgânicas?
- 6 - Diferenças entre Química Inorgânica e Química Orgânica
- 7 - Química Inorgânica no cotidiano
- 8 - Importância da Química Inorgânica
- 9 - História da Química Inorgânica
- 10 - Exercícios resolvidos sobre Química Inorgânica
Resumo sobre Química Inorgânica
- A Química Inorgânica estuda propriedades, estruturas, composição e reações de compostos de origem mineral.
- As funções da Química Inorgânica são: ácidos, bases, sais e óxidos.
- Substâncias inorgânicas são compostos, geralmente de origem mineral, que não contêm carbono em cadeias.
- Está presente no cotidiano em diversos produtos utilizados para fins de limpeza, medicamentos, alimentos e na indústria.
- A Química Inorgânica estuda compostos de origem mineral e que não apresentam cadeias, enquanto a Química Orgânica estuda compostos formados por cadeias e anéis carbônicos.
- A Química Inorgânica se desenvolveu a partir de descobertas de substâncias e observações experimentais realizadas por diferentes alquimistas e cientistas, como Jabir ibn Hayyan, Robert Boyle, Antoine Lavoisier e Linus Pauling.
O que é Química Inorgânica?
A Química Inorgânica é a área da Química que se dedica ao estudo das propriedades, estruturas, reatividade e aplicações de compostos inorgânicos, que são aqueles que não possuem carbono ligados em cadeias. Essa subárea da Química é ampla e engloba uma vasta diversidade de substâncias, desde minerais naturais até compostos sintetizados em laboratório para finalidades específicas.
Os compostos inorgânicos podem ser agrupados em quatro funções principais, conhecidas como funções inorgânicas: ácidos, bases, sais e óxidos. Essas funções são fundamentais para entender a aplicabilidade de determinada substância no dia a dia.
O que se estuda em Química Inorgânica?
→ Compostos inorgânicos
Na Química Inorgânica, se estudam compostos inorgânicos, sua composição estrutural, propriedades e reatividade. Substâncias inorgânicas são compostos, geralmente de origem mineral, que não contêm carbono em cadeias. Os compostos inorgânicos estão divididos em quatro funções principais:
-
- Ácidos: são substâncias que liberam íons H+ (ou H3O+) em solução aquosa.
- Bases: são compostos que liberam íons OH− em solução aquosa.
- Sais: são formados pela reação entre um ácido e uma base.
- Óxidos: compostos formados por oxigênio e outros elementos.
→ Reações inorgânicas
Além de estudar as funções inorgânicas, a Química Inorgânica também classifica as reações químicas que esses compostos sofrem, agrupando-as em diferentes tipos:
- Reações de síntese (ou de adição): envolvem a combinação de duas ou mais substâncias simples para formar um composto mais complexo. A formação da água é uma reação clássica de síntese:
2 H2(g) + O2(g) → 2 H2O(l)
Nesse caso, dois gases simples, o hidrogênio (H2) e o oxigênio (O2), reagem para formar água, um composto essencial para a vida.
- Reações de decomposição (análise): ocorrem quando um composto se quebra em substâncias mais simples. Elas geralmente requerem energia na forma de calor, luz ou eletricidade para ocorrer. A decomposição do carbonato de cálcio (CaCO3) é um exemplo comum em processos industriais:
CaCO3(s) → CaO(s) + CO2(g)
Nessa reação, o carbonato de cálcio se decompõe, formando óxido de cálcio (CaO), conhecido como cal virgem, e dióxido de carbono (CO2). Esse processo é fundamental na produção de cimento.
- Reações de simples troca (deslocamento): ocorrem quando um elemento mais reativo substitui outro em um composto. Geralmente seguem a série de reatividade dos metais ou halogênios. Um exemplo é a reação entre o ferro metálico (Fe) e o sulfato de cobre (CuSO4) em solução aquosa:
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
Nessa reação, o ferro desloca o cobre do composto, formando sulfato de ferro (FeSO4) e cobre metálico (Cu). Esse tipo de reação é frequentemente utilizado para a purificação de metais.
- Reações de dupla troca: envolvem a troca de íons entre dois compostos, formando novos produtos. São comuns em processos de precipitação e neutralização. Um exemplo é a reação de neutralização entre o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH):
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(aq)
Aqui, o íon hidrogênio (H+) do ácido combina-se com o íon hidróxido (OH−) da base para formar água, enquanto o sódio (Na+) e o cloreto (Cl−) formam o sal de cozinha (NaCl).
→ Compostos organometálicos
Além dos compostos clássicos das funções inorgânicas, a Química Inorgânica também estuda os compostos organometálicos, que são substâncias contendo ligações entre átomos de metal e carbono em grupos orgânicos. Esses compostos são importantes na catálise de reações químicas e no desenvolvimento de novos materiais.
Dois exemplos notáveis de compostos organometálicos são o grupo heme e a clorofila, ambos fundamentais para processos biológicos. O grupo heme é uma estrutura organometálica presente na hemoglobina, a proteína responsável pelo transporte de oxigênio no sangue dos vertebrados. Sua estrutura contém um íon ferro (Fe2+) no centro de uma molécula orgânica chamada porfirina, que permite que a hemoglobina se ligue ao oxigênio nos pulmões e o transporte para as células do corpo. Sem o grupo heme, a respiração celular seria comprometida, resultando em deficiência de oxigênio nos tecidos.
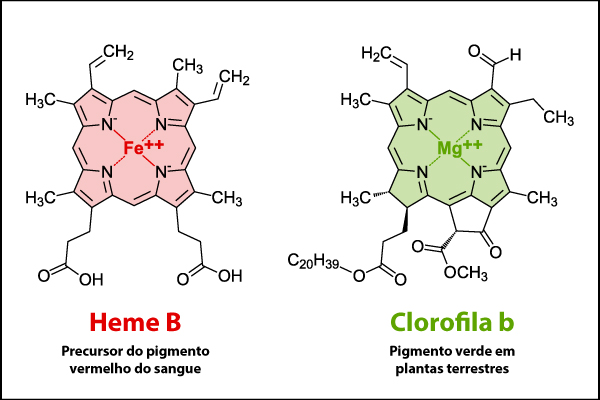
A clorofila é outro exemplo de composto organometálico essencial para a vida. Ela contém um íon magnésio (Mg2+) em sua estrutura e é responsável por absorver luz solar durante o processo de fotossíntese nas plantas, que converte a energia solar em energia química, essencial para a produção de glicose, que serve como fonte de energia para as plantas e outros organismos na cadeia alimentar. A clorofila desempenha um papel crucial no equilíbrio ambiental, sendo a base da produção de oxigênio atmosférico.
Veja também: O que são peróxidos?
Funções inorgânicas
As funções inorgânicas são ácidos, bases, sais e óxidos. Esses grupos reúnem os compostos inorgânicos de acordo com suas propriedades químicas e físicas.
→ Ácidos
São substâncias que, ao serem dissolvidas em água, liberam íons H+ (ou prótons). Esse comportamento químico foi inicialmente descrito por Arrhenius e mais tarde refinado por outras teorias, como a de Brønsted-Lowry e a de Lewis. A ionização do ácido clorídrico (HCl) em água é uma reação clássica que exemplifica o comportamento ácido:
HCl(aq) + H2O(l) → H+(aq) + Cl−(aq)
Aqui, o HCl ioniza-se completamente, liberando íons H+ e Cl−, característica de um ácido forte.
Os ácidos podem ser classificados de acordo com a presença ou ausência de oxigênio em suas moléculas, como:
- Hidrácidos: são ácidos que não possuem oxigênio em sua composição. Exemplos: ácido clorídrico (HCl); ácido sulfídrico (H2S).
- Oxiácidos: são ácidos que possuem oxigênio em sua composição. Exemplos: ácido nítrico (HNO3); ácido sulfúrico (H2SO4)
Também podem ser classificados, considerando o número de hidrogênios ionizáveis, como:
- Monoácidos: possuem apenas um hidrogênio ionizável em sua molécula. Exemplo: ácido nítrico (HNO3).
- Diácidos: possuem dois hidrogênios ionizáveis em sua molécula. Exemplo: ácido sulfúrico (H2SO4).
- Triácidos: possuem três hidrogênios ionizáveis em sua molécula. Exemplo: ácido fosfórico (H3PO4).
- Tetrácidos: possuem quatro hidrogênios ionizáveis em sua molécula. Exemplo: ácido pirofosfórico (H4P2O7).
A força de um ácido é determinada pelo seu grau de ionização, que indica a proporção de moléculas de ácido que se ionizam em solução aquosa. O grau de ionização (α) é dado pela fórmula:
\(\alpha = \frac{\text{número de moléculas ionizadas}}{\text{número total de moléculas dissolvidas}}\)
O valor numérico é multiplicado por 100 para se chegar ao valor percentual referente ao grau de ionização. Com base no grau de ionização, os ácidos podem ser classificados como:
- Ácido forte: ioniza-se completamente em solução, apresentando α > 50%. Exemplo: HCl (α = 92,5%).
- Ácido moderado: ioniza-se parcialmente, apresentando α entre 5% e 50%. Exemplo: H3PO4 (α = 27%).
- Ácido fraco: apresenta baixa ionização, com α < 5%. Exemplo: H2CO3 (α = 0,18%).
Os ácidos desempenham papéis cruciais no cotidiano e em processos industriais, como na fabricação de fertilizantes (ácido sulfúrico) e explosivos (ácido nítrico).
→ Bases
As bases, também conhecidas como hidróxidos, são compostos químicos que, ao serem dissolvidos em água, liberam íons OH− (hidroxila) como principal espécie responsável por suas propriedades químicas. Esse comportamento foi definido inicialmente por Arrhenius, sendo mais tarde complementado pelas teorias de Brønsted-Lowry e Lewis.
A dissociação do hidróxido de sódio (NaOH) em água pode ser representada pela equação:
NaOH(aq) + H2O(l) → Na+(aq) + OH−(aq)
Nesse processo, o NaOH se separa em íons Na+ e OH−, caracterizando uma base forte devido à completa dissociação. A solubilidade das bases em água está diretamente relacionada ao tipo de átomo metálico ligado ao grupo hidroxila (OH−).
- Bases altamente solúveis: incluem os hidróxidos dos metais alcalinos, como NaOH e KOH.
- Bases pouco solúveis: como os hidróxidos dos metais alcalinos-terrosos, como Ca(OH)2 e Mg(OH)2.
- Bases insolúveis: as bases dos demais metais, como Al(OH)3, que apresentam baixa dissociação em água.
As bases são caracterizadas por seu sabor adstringente; embora não seja recomendada a ingestão, esse é um atributo observado experimentalmente. Elas apresentam toque escorregadio, sentido em soluções básicas diluídas, como sabonetes. Além disso, as bases conduzem corrente elétrica e reagem com ácidos, formando sal e água.
As bases podem ser classificadas com base no número de grupos OH− presentes em suas moléculas, como:
- Monobase: bases que possuem apenas um grupo OH−. Exemplo: NaOH, KOH.
- Dibase: bases que possuem dois grupos OH−. Exemplo: Ca(OH)2), Mg(OH)2.
- Tribase: bases que possuem três grupos OH−. Exemplo: Al(OH)3, Fe(OH)3.
- Tetrabase: bases que possuem quatro grupos OH−. Exemplo: Ti(OH)4.
A força de uma base está diretamente relacionada à sua capacidade de liberar íons OH− em solução, ou seja, ao grau de dissociação. O grau de dissociação (α) é definido pela relação:
\(\alpha = \frac{\text{número de íons que se dissociam}}{\text{número total de íons dissolvidos}}\)
Assim como no grau de ionização, o valor numérico é multiplicado por 100 para se chegar ao valor percentual do grau de dissociação. Com base no grau de dissociação, as bases podem ser classificadas em:
- Base forte: dissocia-se completamente em solução aquosa (α > 5%). Exemplo: hidróxido de sódio (NaOH) e hidróxido de potássio (KOH).
- Base fraca: dissocia-se parcialmente em solução (α ≤ 5%). Exemplo: hidróxido de amônio (NH4OH) e hidróxido de alumínio (Al(OH)3).
A força de uma base também pode ser conhecida ao considerar a família do metal ligado ao OH−. Bases fortes são bases dos metais alcalinos e metais alcalinos terrosos. As únicas exceções são os Be(OH)2 e Mg(OH)2, que são bases fracas. São exemplos de bases fortes: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2 e Ba(OH)2. Bases fracas são bases dos demais metais, além do NH4OH. Exemplo de bases fracas: Al(OH)3, Pb(OH)2 e Zn(OH)2.
As bases desempenham um papel central na Química Inorgânica e têm ampla aplicação no cotidiano e na indústria, como na fabricação de produtos de limpeza, neutralização de ácidos e processos químicos industriais.
→ Sais
Os sais são compostos químicos formados pela reação entre um ácido e uma base, em um processo conhecido como reação de neutralização. Nessa reação, os íons H+ do ácido e OH− da base se combinam para formar moléculas de água, enquanto os íons restantes formam o sal.
Os sais são caracterizados pela presença de uma estrutura cristalina formada por cátions e ânions. Muitos sais são solúveis em água, formando soluções eletrolíticas capazes de conduzir corrente elétrica. Os sais estão presentes na natureza em minerais, nos oceanos e são fundamentais em diversos processos biológicos.

A equação geral da reação de neutralização que forma os sais é:
Ácido + Base → Sal + Água
Exemplo: A neutralização do ácido clorídrico (HCl) pelo hidróxido de sódio (NaOH):
HCl(aq) + NaOH(aq) → NaCl(s) + H2O(l)
Os sais podem ser classificados neutros, ácidos ou básicos, considerando a presença ou ausência de íons hidrogênio (H+) e hidróxido (OH-) em sua composição.
- Sal neutro: é formado pela neutralização completa de um ácido forte por uma base forte ou vice-versa. Não apresentam H+ (íon hidrogênio) nem OH− (íon hidroxila) na estrutura. Exemplo: cloreto de sódio (NaCl), obtido pela reação:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
- Sal ácido (hidrogenossal): é formado pela neutralização parcial de um ácido que possui mais de um hidrogênio ionizável. Esses sais ainda contêm hidrogênios ionizáveis em sua estrutura. Exemplo: bissulfato de sódio (NaHSO4), formado pela reação:
H2SO4 + NaOH → NaHSO4 + H2O
O bicarbonato de sódio (NaHCO3) é outro exemplo de sal ácido.
- Sal básico (hidroxissal): formados pela neutralização parcial de uma base que possui mais de um grupo OH−OH^-OH−. Esses sais ainda contêm hidroxilas em sua composição. Exemplo: cloreto básico de magnésio (Mg(OH)Cl), formado pela reação:
Mg(OH)2 + HCl → Mg(OH)Cl + H2O
O hidróxido-carbonato de cobre (Cu2(OH)2CO3), que é usado como pigmento verde, é outro exemplo de sal básico. Os sais desempenham funções essenciais em diversas áreas da ciência e da vida cotidiana. Além do uso do sal de cozinha (NaCl) na alimentação, outros sais são utilizados na produção de fertilizantes, medicamentos, tratamentos de água e até mesmo como eletrólitos em baterias.
→ Óxidos
Os óxidos são compostos binários formados por oxigênio e outro elemento químico, sendo o oxigênio o elemento mais eletronegativo da molécula, com exceção dos fluoretos de oxigênio (OF2 e O2F2). Esses compostos apresentam propriedades químicas variadas, que dependem do elemento ao qual o oxigênio está ligado e da estrutura molecular do óxido.
Os óxidos podem ser sólidos, líquidos ou gasosos, dependendo da composição e da temperatura ambiente, sendo amplamente encontrados na natureza, na forma de minerais e componentes atmosféricos. Eles interagem com outros compostos, como ácidos e bases, formando sais e água em muitas reações.
Os óxidos podem ser classificados como iônicos ou moleculares, com base em sua ligação química.
- Óxidos iônicos: são formados pela ligação entre o oxigênio e metais de baixa eletronegatividade, como os metais alcalinos e alcalinoterrosos. Apresentam caráter básico e formam soluções alcalinas em água. Exemplo: óxido de sódio (Na2O).
Na2O + H2O → 2 NaOH
- Óxidos moleculares: são formados pela ligação do oxigênio com elementos de alta eletronegatividade, como ametais ou metais de transição com altos números de oxidação. Geralmente apresentam caráter ácido. Exemplo: dióxido de enxofre (SO2).
SO2 +H2O → H2SO3
Os óxidos também são classificados em quatro categorias principais com base em suas propriedades ácido-base.
- Óxidos ácidos: também chamados de anidridos ácidos, reagem com água para formar ácidos e com bases para formar sais. Geralmente, são compostos por ametais ou metais com alto número de oxidação. Exemplo: trióxido de enxofre (SO3).
SO3 + H2O → H2SO4
- Óxidos básicos: reagem com água para formar bases e com ácidos para formar sais. São formados por metais de baixa eletronegatividade, geralmente metais alcalinos e alcalinoterrosos. Exemplo: óxido de cálcio (CaO).
CaO + H2O → Ca(OH)2
- Óxidos neutros: não reagem com ácidos, bases ou água, apresentando comportamento químico estável. Esses compostos são raros e geralmente formados por ametais com números de oxidação específicos. Exemplo: monóxido de carbono (CO), monóxido de nitrogênio (NO) e monóxido de dinitrogênio (N2O).
- Óxidos anfóteros: possuem comportamento dual, reagindo tanto com ácidos quanto com bases para formar sais. Geralmente são formados por metais de transição com números de oxidação intermediários. Exemplo: óxido de zinco (ZnO).
- Reação com ácido: ZnO(s) + 2 HCl(aq) → ZnCl2(aq) + H2O(l)
- Reação com base: ZnO(s) + 2 NaOH(aq) → Na2ZnO2(aq) + H2O(l)
Os óxidos desempenham um papel fundamental em várias áreas da ciência e da tecnologia, desde processos industriais, como a fabricação de cimento e vidros, até fenômenos naturais, como a formação de chuva ácida.
O que são substâncias inorgânicas?

Substâncias inorgânicas são compostos químicos que, em sua maioria, têm origem mineral. As inorgânicas abrangem uma ampla variedade de elementos químicos, resultando em uma diversidade de estruturas, propriedades e aplicações. Essas substâncias estão presentes em todos os aspectos do cotidiano, desde minerais e rochas até produtos industriais, medicamentos e soluções biológicas.
Sua formação pode ocorrer naturalmente, como no caso da água e dos minerais, ou artificialmente, em processos laboratoriais e industriais. As substâncias inorgânicas são tradicionalmente agrupadas em quatro grandes funções químicas: ácidos, bases, sais e óxidos.
Diferenças entre Química Inorgânica e Química Orgânica
A Química Inorgânica e a Química Orgânica se diferem significativamente em seus objetos de estudo, aplicações e propriedades, embora ambas compartilhem conceitos fundamentais e métodos de estudo.
A principal diferença entre Química Orgânica e Inorgânica está nos tipos de compostos que cada uma aborda. A Química Orgânica estuda os compostos do carbono, principalmente aqueles que formam cadeias e anéis carbônicos. Os compostos orgânicos incluem hidrocarbonetos, álcoois, ácidos carboxílicos, polímeros, entre outros.
A presença do carbono é o traço distintivo, embora nem todo composto contendo carbono seja considerado orgânico (como CO2 e CaCO3, que são estudados pela Química Inorgânica). Por sua vez, a Química Inorgânica abrange todos os outros compostos químicos que não se enquadram na definição de orgânicos. Inclui substâncias como ácidos, bases, sais, óxidos, minerais e metais.
Historicamente, a Química Orgânica era associada a compostos provenientes de organismos vivos, enquanto a Inorgânica estudava substâncias minerais. Atualmente, essa divisão já não se aplica rigidamente, mas há diferenças em termos de abundância e origem. Compostos orgânicos estão presentes em organismos vivos, alimentos, combustíveis fósseis e polímeros sintéticos. Compostos inorgânicos predominam na crosta terrestre e na atmosfera, a exemplo dos minerais, gases atmosféricos e substâncias produzidas em processos industriais.
Química Inorgânica no cotidiano
A Química Inorgânica está presente em praticamente todos os aspectos da nossa vida diária, desde os produtos de limpeza até os alimentos que consumimos. Sua utilidade está associada às propriedades químicas e físicas dos ácidos, bases, sais e óxidos.
Os ácidos são amplamente utilizados em processos industriais, além da medicina e saúde:
- O ácido fosfórico (H3PO4) é utilizado como acidulante em refrigerantes e bebidas carbonatadas.
- O ácido nítrico (HNO3) é utilizado na fabricação de fertilizantes e explosivos.
- O ácido bórico (H3BO3) é utilizado em soluções oftálmicas e como antisséptico leve.
As bases, comumente reconhecidas por sua sensação escorregadia e propriedades neutralizantes, também têm várias aplicações práticas:
- Hidróxido de sódio (NaOH) e hidróxido de potássio (KOH) são usados na fabricação de sabões e detergentes, que atuam como agentes de limpeza eficientes ao dissolver gorduras.
- O bicarbonato de sódio (NaHCO3) é utilizado como fermento químico em bolos e pães. Quando aquecido, libera CO2, promovendo o crescimento da massa.

- Bases como o hidróxido de cálcio (Ca(OH)2) são usadas para corrigir a acidez da água em estações de tratamento.
Os sais, resultado da neutralização entre ácidos e bases, desempenham um papel essencial em diversas atividades cotidianas.
- O cloreto de sódio (NaCl), conhecido como sal de cozinha, é indispensável na alimentação, atuando como tempero e conservante.
- O nitrato de potássio (KNO3) é usado em medicamentos para tratar hipertensão. Outro exemplo é o carbonato de cálcio (CaCO3), presente em antiácidos para alívio de desconfortos estomacais.
- O sulfato de cálcio (CaSO4) é empregado na fabricação de cimento e gesso, enquanto o carbonato de sódio (Na2CO3) é utilizado na produção de vidro e detergentes.
Os óxidos são compostos versáteis que têm usos variados em diferentes setores.
- O dióxido de silício (SiO2), encontrado em areia e quartzo, é usado na fabricação de vidro e concreto.
- O óxido de cálcio (CaO), também conhecido como cal virgem, é empregado no tratamento de resíduos sólidos.
- O óxido de ferro (Fe2O3) é utilizado como pigmento em tintas e na produção de aço, essencial para a construção e fabricação de equipamentos.
- O óxido nitroso (N2O), conhecido como gás do riso, é usado como anestésico em procedimentos odontológicos e cirúrgicos.
Importância da Química Inorgânica
A Química Inorgânica desempenha um papel crucial em diversos aspectos da vida, destacando-se como um pilar fundamental para o desenvolvimento da sociedade moderna. A Química Inorgânica é essencial na medicina e na saúde. Compostos inorgânicos, como sais de cálcio e magnésio, são indispensáveis para o funcionamento do organismo humano, contribuindo para a formação óssea e o metabolismo.
Medicamentos, como antiácidos à base de hidróxido de alumínio (Al(OH)3), e compostos quimioterápicos, como a cisplatina ([Pt(NH3)2Cl2]), exemplificam o uso de compostos inorgânicos no tratamento de doenças.
A preservação ambiental também se beneficia da Química Inorgânica. Por exemplo, óxidos e hidróxidos de metais, como o óxido de magnésio (MgO), são utilizados no tratamento de águas residuais para neutralizar ácidos. Além disso, catalisadores inorgânicos, como o dióxido de titânio (TiO2), ajudam a reduzir poluentes atmosféricos em processos industriais.
No dia a dia, a Química Inorgânica está presente em produtos como fertilizantes, que garantem a produtividade agrícola, e em itens de limpeza, como o hipoclorito de sódio (NaClO), usado como desinfetante. Além disso, ácidos, bases e sais inorgânicos estão em materiais de construção, cosméticos e alimentos. A indústria química depende amplamente da Química Inorgânica para a produção de materiais essenciais, como aço, alumínio e cerâmica. A fabricação de vidros, tintas, plásticos e semicondutores também utiliza compostos inorgânicos, como o dióxido de silício (SiO2).
Na tecnologia, a Química Inorgânica possibilita avanços como baterias de íons de lítio (Li), fundamentais para dispositivos eletrônicos e veículos elétricos. Catalisadores inorgânicos impulsionam a eficiência de processos industriais e reações químicas. Além disso, semicondutores à base de silício (Si) são essenciais na fabricação de chips eletrônicos.
A Química Inorgânica auxilia na compreensão da estrutura da matéria e na criação de novos materiais com propriedades específicas, como supercondutores e materiais inteligentes. Essas aplicações da Química Inorgânica ajudam a compreender a sua relevância tanto na solução de desafios globais quanto na melhoria da qualidade de vida cotidiana.
História da Química Inorgânica
A história da Química Inorgânica remonta à Antiguidade, quando filósofos naturais procuravam entender os elementos que compõem o universo. Essa busca levou ao desenvolvimento da alquimia, abrindo os caminhos para a Química que conhecemos atualmente.
Durante a Idade Média, a Química Inorgânica foi impulsionada pela alquimia, um campo misto de ciência, misticismo e filosofia. Alquimistas árabes, como Jabir ibn Hayyan (Geber), desenvolveram técnicas importantes, como destilação e cristalização, além de descobrirem substâncias como o ácido nítrico (HNO3) e o ácido clorídrico (HCl).
O avanço da Química Inorgânica ganhou impulso durante a Revolução Científica, no século XVII, com a sistematização do método científico. Robert Boyle, conhecido como o pai da Química moderna, rejeitou as teorias alquímicas e focou a experimentação e a análise quantitativa, introduzindo conceitos fundamentais sobre gases e suas propriedades. Boyle também dedicou-se aos estudos dos ácidos e alcalinos, descrevendo inúmeras propriedades. Ele foi o primeiro a descrever a coloração esverdeada, apresentada pelos sais de cobre à chama, assim como a precipitação da prata por cloreto e do cálcio por sulfato.
No século XVIII, Antoine Lavoisier revolucionou a Química ao formular a lei da conservação da massa e identificar o papel do oxigênio nas reações de combustão. Ele classificou substâncias em ácidos, bases e sais, fornecendo uma base para a Química Inorgânica.
Com a introdução da tabela periódica por Dmitri Mendeleev, em 1869, a Química Inorgânica se tornou mais estruturada. A organização dos elementos permitiu prever propriedades de substâncias ainda não descobertas, consolidando a Química como uma ciência rigorosa. No mesmo período, Humphry Davy contribuiu significativamente, isolando elementos como sódio (Na), potássio (K) e cálcio (Ca) por meio da eletrólise. Suas descobertas expandiram o conhecimento sobre metais alcalinos e alcalinoterrosos.
O desenvolvimento da teoria ácido-base por Svante Arrhenius, que relacionou a dissociação de substâncias em água com a formação de íons, foi outro marco. Essa teoria forneceu uma compreensão mais profunda das reações químicas envolvendo ácidos, bases e sais.
No século XX, a Química Inorgânica consolidou-se como um campo distinto, explorando compostos metálicos, organometálicos e complexos de coordenação. Alfred Werner recebeu o Prêmio Nobel de Química em 1913 por seu trabalho pioneiro na estrutura dos compostos de coordenação, o que abriu caminho para estudos de catálise e materiais avançados. Os avanços na Química Inorgânica foram reconhecidos com diversos prêmios Nobel.
Linus Pauling, outro gigante da Química, utilizou a teoria da ligação química para explicar as propriedades de compostos inorgânicos. Seu trabalho sobre a eletronegatividade e as ligações covalentes foi fundamental para o entendimento das interações químicas.
A Química Inorgânica também desempenhou um papel crucial no desenvolvimento de tecnologias como catalisadores industriais e semicondutores, essenciais para a revolução tecnológica. Atualmente, a Química Inorgânica continua a expandir fronteiras. A pesquisa sobre materiais avançados, como supercondutores e nanomateriais, tem aplicações em energia renovável, eletrônica e medicina.
O desenvolvimento de compostos inorgânicos para captura de dióxido de carbono (CO2) é uma esperança no combate às mudanças climáticas, mostrando como a Química Inorgânica é vital para enfrentar desafios globais.
Saiba mais: Ácido sulfúrico — uma das substâncias mais utilizadas no mundo
Exercícios resolvidos sobre Química Inorgânica
Questão 1: (Enem 2021) No cultivo por hidroponia, são utilizadas soluções nutritivas contendo micronutrientes e micronutrientes essenciais. Além dos nutrientes, o pH é um parâmetro de extrema importância, uma vez que ele afeta a preparação da solução nutritiva e a absorção dos nutrientes pelas plantas. Para o cultivo de alface, os valores de pH entre 5,5 e 6,5 são ideais para o seu desenvolvimento. As correções de pH são feitas pela adição de compostos ácidos ou básicos, mas não devem introduzir elementos nocivos às plantas. Na tabela, são apresentados alguns dados da composição da solução nutritiva de referência para esse cultivo. Também é apresentada a composição de uma solução preparada por um produtor de cultivo hidropônico.
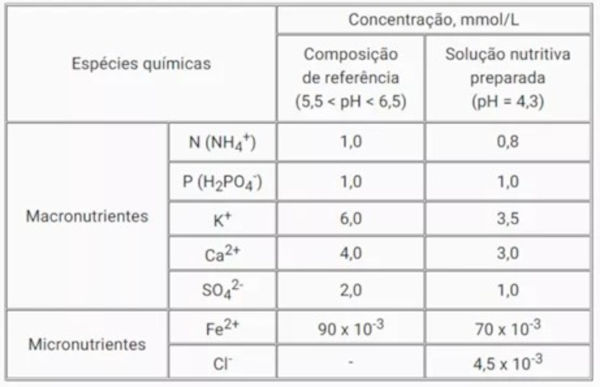
LENZI, E; FAVERO, L. O. B.; LUCHESE, E. B. Introdução à química da água: ciência vida e sobrevivência. Rio de Janeiro, LTC, 2012 (adaptado).
Para correção do pH da solução nutritiva preparada, esse produtor pode empregar uma solução de
A) ácido fosfórico, H3PO4.
B) sulfato de cálcio, CaSO4.
C) óxido de alumínio, Al2O3.
D) cloreto de ferro (II), FeCl2.
E) hidróxido de potássio, KOH.
Resposta:
A resposta correta é: E) hidróxido de potássio, KOH.
Análise da questão e das alternativas:
O problema: A solução nutritiva preparada pelo produtor possui um pH de 4,3, enquanto o pH ideal para o cultivo de alface está entre 5,5 e 6,5. Portanto, é necessário aumentar o pH da solução, tornando-a mais básica. O que cada substância faz:
- Ácido fosfórico (H₃PO₄): é um ácido, ou seja, ao ser adicionado à solução, ele diminuiria ainda mais o pH, o que não é desejável.
- Sulfato de cálcio (CaSO₄): é um sal neutro, ou seja, não altera significativamente o pH da solução.
- Óxido de alumínio (Al₂O₃): é um óxido anfótero, ou seja, pode apresentar tanto caráter ácido quanto básico, dependendo das condições. No entanto, a adição de um óxido à solução pode introduzir alumínio, que é um elemento tóxico para as plantas em altas concentrações.
- Cloreto de ferro (II) (FeCl₂): é um sal que, ao se dissolver em água, libera íons Fe²⁺ e Cl⁻. O íon Fe²⁺ é um micronutriente essencial para as plantas, mas o excesso de cloreto pode ser prejudicial.
- Hidróxido de potássio (KOH): é uma base forte. Ao ser adicionado à solução, ela irá aumentar o pH, tornando-a mais básica, o que é exatamente o que precisamos para corrigir o pH da solução nutritiva. Além disso, o potássio (K⁺) é um macronutriente essencial para as plantas.
Dessa forma, a única substância que aumentará o pH da solução sem introduzir elementos nocivos às plantas é o hidróxido de potássio (KOH). Ao adicionar KOH, o produtor estará corrigindo o pH da solução nutritiva e, ao mesmo tempo, fornecendo potássio para as plantas.
Questão 2: (Enem 2018) O manejo adequado do solo possibilita a manutenção de sua fertilidade à medida que as trocas de nutrientes entre matéria orgânica, água, solo e o ar são mantidas para garantir a produção. Algumas espécies iônicas de alumínio são tóxicas, não só para a planta, mas para muitos organismos como as bactérias responsáveis pelas transformações no ciclo do nitrogênio. O alumínio danifica as membranas das células das raízes e restringe a expansão de suas paredes, com isso a planta não cresce adequadamente. Para promover benefícios para a produção agrícola, é recomendada a remediação do solo utilizando calcário (CaCo3).
RANDY, N, C; WEIL, R.R Elementos da natureza e propriedades dos solos. Porto Alegre: Bookman, 2013(adaptado).
Essa remediação promove no solo o(a)
A) diminuição do pH, deixando-o fértil.
B) solubilização do alumínio, ocorrendo sua lixiviação pela chuva.
C) interação do íon cálcio com o íon alumínio, produzindo uma liga metálica.
D) reação do carbonato de cálcio com os íons alumínio, formando alumínio metálico.
E) aumento da sua alcalinidade, tomando os íons alumínio menos disponíveis.
Resposta:
A resposta correta é: E) aumento da sua alcalinidade, tomando os íons alumínio menos disponível.
Análise das alternativas:
A) diminuição do pH, deixando-o fértil: Incorreta. O calcário aumenta o pH do solo, tornando-o mais alcalino, e não mais ácido.
B) solubilização do alumínio, ocorrendo sua lixiviação pela chuva: Incorreta. O calcário, ao aumentar o pH, diminui a solubilidade do alumínio, impedindo sua lixiviação.
C) interação do íon cálcio com o íon alumínio, produzindo uma liga metálica: Incorreta. A formação de ligas metálicas envolve a ligação entre metais, e não entre um cátion e um metal.
D) reação do carbonato de cálcio com os íons alumínio, formando alumínio metálico: Incorreta. A reação do calcário com o alumínio não resulta na formação de alumínio metálico.
E) aumento da sua alcalinidade, tomando os íons alumínio menos disponíveis: Correta. Ao adicionar calcário ao solo, aumenta-se a concentração de íons cálcio (Ca²⁺). Esses íons competem com os íons alumínio (Al³⁺) por sítios de adsorção nas partículas do solo. Como o cálcio é menos tóxico e tem maior capacidade de adsorção, ele "desloca" o alumínio, tornando-o menos disponível para as plantas e microrganismos. Além disso, o aumento do pH causado pelo calcário reduz a solubilidade do alumínio, precipitando-o.
Fontes
BROWN, T. L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, R. Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.
National Geographic Portugal. Robert Boyle, o primeiro químico moderno. 2022. Disponível em: https://www.nationalgeographic.pt/historia/robert-boyle-o-primeiro-quimico-moderno_296


