Óxido é uma função inorgânica que apresenta compostos (substâncias) que possuem em sua constituição apenas dois elementos químicos diferentes, independentemente da quantidade de átomos, sendo, por isso, compostos binários. Dos dois elementos químicos que formam um óxido, um deles obrigatoriamente tem que ser o oxigênio e o outro um elemento qualquer (metal, ametal ou semimetal). Além disso, na molécula do óxido, o oxigênio é obrigatoriamente o elemento mais eletronegativo.
Observação: Em um óxido, o nox (número de oxidação) do oxigênio é sempre igual a -2.
O estudo dos óxidos envolve vários componentes importantes, como nomenclatura e classificação. De acordo com a classificação dos óxidos, podemos ter óxidos ácidos, óxidos básicos, óxidos duplos, óxidos anfóteros e os óxidos neutros. Neste texto daremos ênfase aos chamados óxidos neutros.
O óxido neutro apresenta natureza molecular (formado por um ametal diferente do flúor acompanhando o oxigênio), sendo formado por ligações químicas covalentes. Trata-se de um grupo de óxidos que não apresenta um número muito grande de representantes. A seguir estão listados os principais óxidos neutros:
-
Monóxido de carbono (CO)
-
Monóxido de dinitrogênio ou óxido nitroso (N2O)
-
Monóxido de nitrogênio ou óxido nítrico (NO)
O que diferencia um óxido neutro dos outros óxidos é o fato de ele não reagir quimicamente com água, ácidos e bases. É por essa razão que ele é chamado de neutro. Mas vale ressaltar que ele reage quimicamente com outras substâncias, como é o caso da reação química entre o NO e o gás oxigênio (O2). Acompanhe a reação que representa o processo descrito:
2 NO + O2 → 2 NO2
Os estudos desse composto possibilitaram várias descobertas interessantes. A seguir temos informações sobre as vantagens e desvantagens dos três óxidos neutros listados acima.
1) Monóxido de carbono (CO)
Em temperatura ambiente, é um gás incolor e inodoro. É muito perigoso em razão de sua alta toxicidade quando inalado. Graças à sua capacidade de interagir com a hemoglobina das hemácias, o monóxido de carbono consegue inativá-las para o transporte de gás oxigênio ou carbônico.
Esse gás pode ser formado por ação natural (por vulcões, descargas elétricas na atmosfera e pelo gás natural) ou por ação humana (queima de combustíveis fósseis, atividades termoelétricas, queima do cigarro e carvão, entre outras).
Apesar de o monóxido de carbono ser bastante tóxico, ele possui algumas utilizações específicas que beneficiam o homem, tais como as sínteses orgânicas e a produção de metais.
Obs.: O monóxido de carbono polui o meio ambiente porque, ao reagir com o oxigênio do ar, forma o dióxido de carbono (CO2)
2) Monóxido de dinitrogênio ou óxido nitroso (N2O)
Esse óxido recebeu inicialmente a denominação de gás do riso ou gás hilariante porque, quando inalado, provoca uma crise de riso no indivíduo. Não é um gás inflamável, apresenta baixa solubilidade em água e é muito utilizado em duas áreas:
-
médica e odontológica (como agente anestésico com outras substâncias anestésicas)
-
automobilístico (por aumentar a potência de motores), nos chamados carros tunados.
Obs.: O óxido nitroso é considerado o terceiro gás mais importante que contribui para o efeito estufa. Ele é produzido pela queima de combustíveis fósseis, tratamento de efluentes e também pela fertilização do solo.
3) Monóxido de nitrogênio ou óxido nítrico (NO)
É um óxido gasoso muito importante no que diz respeito à área medicinal. É produzido no interior de células chamadas macrófagos e também em células endoteliais de artérias, por exemplo. Em laboratório, ele é obtido pela reação entre o ácido nítrico (HNO3) e o cobre metálico (Cu).
Dentre os benefícios e utilizações do NO, podemos destacar:
-
relaxamento muscular de vasos sanguíneos (controla a pressão arterial);
-
destruição de células causadoras de processos inflamatórios;
-
participa da produção do viagra;
-
participa da produção do medicamento para angina.
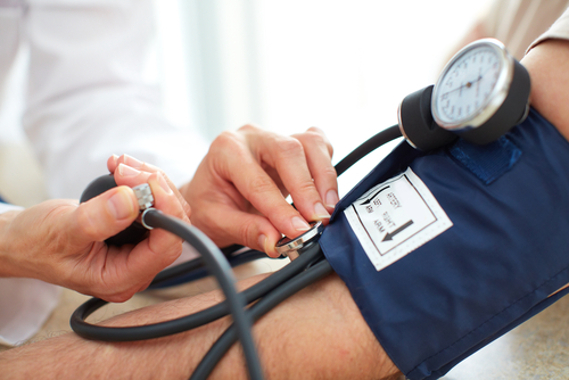
O óxido nítrico participa do controle da pressão arterial
Obs.: O óxido nítrico é um gás extremamente tóxico que, em grandes concentrações, pode trazer diversos danos ao indivíduo, tais como:
-
dano tecidual;
-
choque séptico;
-
hemorragia digestiva;
-
isquemia;
-
asma.
Ele é um poluidor atmosférico porque, quando reage com o oxigênio na atmosfera, forma óxidos que participam do processo de formação da chuva ácida. Vale ressaltar que ele é formado na atmosfera pela reação entre os gases nitrogênio (N2) e oxigênio (O2) em presença de descargas elétricas. Veja a equação de formação do NO na atmosfera:
N2 + O2 → 2 NO
Ao reagir com o oxigênio, o óxido nítrico forma o NO2, que participa do processo de formação da chuva ácida. Veja as equações:
2 NO + O2 → 2 NO2 (reação de formação do óxido NO2)
2 NO2 + H2O → HNO3 + HNO2
(ácidos HNO3 e HNO2 que se formam nessa reação e descem com a chuva)

Toda chuva é ácida
Por Me. Diogo Lopes Dias

