Fósforo branco é uma forma alotrópica do elemento químico fósforo, comumente representado pela fórmula molecular P4. Apesar de ser chamado de fósforo branco, sua coloração mais remete à cera ou ao amarelado. O fósforo branco é tratado como a forma mais estável do fósforo, embora não seja a mais termodinamicamente estável.
O fósforo branco tem poucos usos diretos na indústria, sendo geralmente convertido ao alótropo vermelho, o qual possui mais utilizações diretas e é menos tóxico. Contudo, o fósforo branco é empregado em conflitos militares como agente causador de fumaça, para iluminação e também para criar incêndios, já que o fósforo branco entra em ignição em contato com o ar e em temperaturas pouco maiores que 30 °C.
Leia também: Quais são as formas alotrópicas do enxofre?
Tópicos deste artigo
- 1 - Resumo sobre o fósforo branco
- 2 - O que é o fósforo branco?
- 3 - Composição do fósforo branco
- 4 - Para que serve o fósforo branco?
- 5 - Uso do fósforo branco na guerra
- 6 - Diferenças entre fósforo branco e fósforo vermelho
Resumo sobre o fósforo branco
-
O fósforo branco é uma forma alotrópica do fósforo, representado pela fórmula P4.
-
Tem uma coloração amarelada, próxima a cor de cera.
-
Pode ser produzido a partir de rochas fosfáticas, areia e coque em altas temperaturas.
-
É muito pouco solúvel em água e entra em ignição em temperaturas pouco acima dos 30 °C.
-
Não é muito usado na indústria, mas é a principal forma elementar produzida do fósforo.
-
É utilizado em conflitos e guerras como agente causador de fumação, de incêndios e para iluminação.
-
Possui mais utilizações diretas que o fósforo branco e é também menos tóxico do que ele.
O que é o fósforo branco?
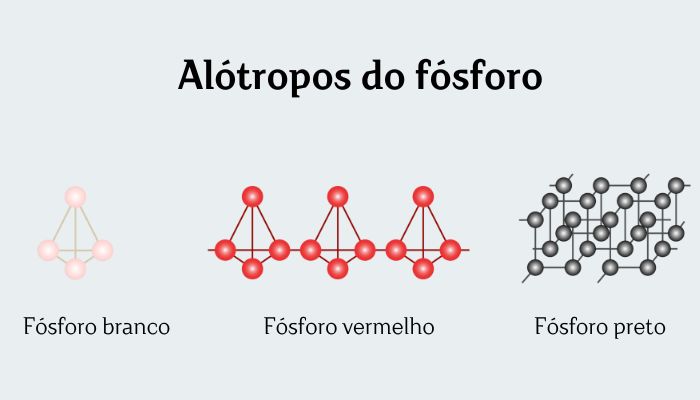
O fósforo branco é uma das 12 formas alotrópicas que existem do elemento químico fósforo, sendo comumente representado como P4.
Nos tempos antigos, a urina era a única fonte conhecida para o elemento fósforo e, por isso, todos os trabalhos sobre esse elemento faziam referência da produção a partir da urina. O fósforo produzido nesse processo tinha uma coloração branca (ou amarelada, tipo cera), fazendo com que o fósforo branco fosse a primeira forma alotrópica desse elemento, trazendo-lhe também maior fama.
Posteriormente, na segunda metade do século XIX, descobriu-se que o fósforo branco poderia ser produzido a partir do aquecimento de rochas de fosfato, com areia e coque. Esse método foi aprimorado para a forma moderna de produção do fósforo branco, que consiste na utilização de uma fornalha elétrica (que atinge temperaturas na faixa de 1.400 a 1.500 °C) para aquecimento de uma rocha de fosfato (Ca3(PO4)2), areia (sílica, SiO2) e coque (carbono).
2 Ca3(PO4)2 + 6 SiO2 + 10 C → P4 + 6 CaSiO3 + 10 CO
Os vapores de fósforo são condensados, formando um sólido com aspecto de cera que é insolúvel em água.
Composição do fósforo branco
O fósforo branco é convencionado como a forma mais estável do fósforo, embora seja, na verdade, metastável (seu aquecimento faz chegar nas formas alotrópicas termodinamicamente mais estáveis, vermelha e preta).
Apresenta-se na forma cristalina como moléculas de P4 tetraédricas com ligações P─P de comprimento igual a 221 pm. É solúvel em benzeno, PCl3 e CS2, muito pouco solúvel em água. Aliás, o fósforo branco é guardado dentro de água, de modo a impedir a sua oxidação.
No ar úmido, sofre uma oxidação quimioluminescente, emitindo um brilho verde e se transformando, lentamente, em P4O8 e O3.
Para que serve o fósforo branco?
O fósforo branco tem ampla utilização na indústria militar, como produtor de fumaça e para preenchimento de projéteis e granadas.
Na indústria de forma geral, ele é produzido como fósforo elementar a partir das rochas fosfáticas, para então ser convertido em fósforo vermelho, outra forma alotrópica, o qual possui comportamento químico diferente. O fósforo vermelho tem maior aplicação geral, sendo usado para produção de palitos de fósforo, fosfeto de alumínio, retardantes de chama e para fins de pirotecnia. O fósforo branco é também a principal forma de produzir compostos de maior pureza que possam conter fósforo. Dele também se produz o PCl3, por meio da reação com Cl2.
Veja também: Afinal, o fósforo está na caixinha ou está no palito?
Uso do fósforo branco na guerra
O fósforo branco acaba sendo utilizado para fins bélicos, por conta da sua autoignição em baixa temperatura: acima dos 50 °C (alguns autores dizem acima dos 34 °C), em contato com o ar, o fósforo branco se inflama, produzindo o pentóxido de fósforo (P4O10).
→ Bomba de fósforo branco
O fósforo branco entra em ignição em baixas temperaturas. Por isso, a utilização do fósforo branco como uma arma incendiária é comum em conflitos. Seu uso não é baseado na letalidade, mas sim para criar um incêndio, iluminação ou até mesmo uma cortina de fumaça para auxiliar na fuga ou recuo de tropas. A formação de fumaça ocorre quando a temperatura é suficientemente alta em relação à temperatura de início de autoignição da forma alotrópica.

Por existirem os usos citados do fósforo branco (iluminação, cortina de fumaça e promoção de incêndio), convenções internacionais não proíbem a utilização dele em conflitos. A Convenção para Armas Químicas da ONU (CWC) não é considerada como arma química. A única questão é que, se usado para incendiar pessoas em alvos civis diretamente, o fósforo branco pode infringir o Protocolo III da Convenção sobre Certas Armas Convencionais (CCCW). Contudo, tal fato precisaria ser comprovado por uma investigação dos órgãos competentes.
→ Efeitos da exposição ao fósforo branco
Uma vez incendiado, o fogo do fósforo branco é difícil de ser extinguido. Adere muito facilmente à pele e às roupas, causando queimaduras significativas. Além disso, mesmo após tratamento inicial, o fósforo branco pode sofrer reignição se ainda em contato com o ar. Por isso, a remoção de qualquer resquício de fósforo das feridas é essencial.
Num primeiro momento, a lavagem com água e soluções salinas é essencial, pois isso pode não só diminuir a temperatura, como também acabar com a combustão e remover qualquer traço de ácido fosfórico diluído que possa ter sido formado. A absorção de fósforo pela queimadura pode gerar desvios nos níveis de cálcio e fósforo do corpo, podendo gerar, rapidamente, hipocalcemia e hiperfosfatemia, as quais podem ser causa de arritmia cardíaca fatal.
A fumaça é extremamente irritante às mucosas, onde se combina com a água para a formação de ácido fosfórico. A inalação da fumaça de fósforo branco causa irritação ao trato respiratório, gerando tosse, dor de cabeça e edema pulmonar tardio.
O fósforo branco é muito tóxico aos seres humanos, sendo rapidamente absorvido para o sangue e o fígado. A ingestão de 100 mg pode ser fatal por conta de falência do fígado. Já a exposição lenta, prolongada, de pequenas quantidades, também causa consequências horríveis. A condição mais comum é a mandíbula de fósforo, a qual acometeu diversos trabalhadaores de fábricas de fósforo no fim do século XIX e começo do século XX.
Diferenças entre fósforo branco e fósforo vermelho
O fósforo branco e vermelho são formas alotrópicas diferentes do elemento químico fósforo, ambas representadas por P4.
O fósforo vermelho pode ser obtido do fósforo branco por meio de seu aquecimento, em atmosfera inerte, em uma temperatura na faixa de 540 K (267 °C). Foi primeiro obtido por Anton von Schötter, em 1845.
Existem diversas formas cristalinas de fósforo vermelho. Uma delas é a de Hittorf (também conhecida como fósforo violeta), que consiste em uma longa e complexa cadeia de fósforo.
O fósforo vermelho é menos denso que o branco, possui um maior ponto de fusão e é menos reativo. Além disso, o fósforo vermelho também não é considerado tóxico, o que o torna mais fácil e seguro de ser manuseado.
Fontes
CHOU, T.-D.; LEE, T.-W.; CHEN, S.-L.; TUNG, Y.-M.; DAI, N.-T.; CHEN, S.-G.; LEE, C.-H.; CHEN, T.-M.; WANG, H.-J. The management of white phosphorus burn. Burns, n. 27, p. 492-497, 2001.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 2. ed. Pearson Education Limited: Londres, 2005.
KELLY, P. F. Phosphorus: Inorganic Chemistry. In: Encyclopedia of Inorganic Chemistry. 2. ed. Wiley: Nova Jersey, 2005.
WORLD HEALTH ORGANIZATION. White phosphorus. World Health Organization, 20 out. 2023. Disponível em: https://www.who.int/news-room/fact-sheets/detail/white-phosphorus.

