A Teoria da Hibridização surgiu como um complemento à Teoria do Octeto, conseguindo explicar a estrutura de um número maior de moléculas, incluindo moléculas formadas pelo boro (B).
Esse elemento possui cinco elétrons no estado fundamental, com a seguinte configuração eletrônica:
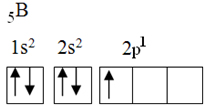
Pela teoria do octeto, o boro poderia realizar somente uma ligação covalente, pois ele possui somente um orbital atômico incompleto. No entanto, experimentalmente, nota-se que esse elemento forma compostos em que ele realiza mais de uma ligação.
Um exemplo é o trifluoreto de boro (BF3). Como mostrado abaixo, o boro realiza três ligações covalentes com o flúor, compartilhando três pares de elétrons e ficando com seis elétrons na sua última camada (camada de valência), ou seja, uma exceção à regra do octeto.
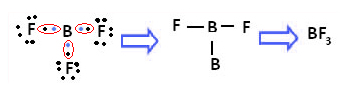
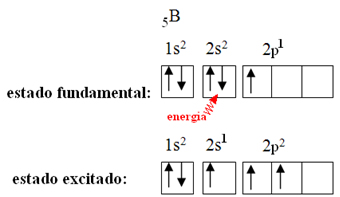
Isso é explicado pelo fenômeno da hibridização que ocorre com o boro. Acontece que um elétron do subnível 2s absorve energia e passa para o estado excitado, no qual ele salta para um orbital vazio do subnível 2p. Formam-se, desse modo, três orbitais incompletos, que podem agora realizar três ligações covalentes:
Porém, as ligações formadas no trifluoreto de boro são todas iguais, mas se observarmos acima, são duas ligações diferentes, uma vez que uma delas seria feita por meio de um orbital do tipo s e as outras duas por meio de um orbital do tipo p. É aqui que ocorre a hibridização, ou seja, os orbitais incompletos fundem-se, originando três orbitais híbridos ou hibridizados, que são idênticos e diferentes dos originais:
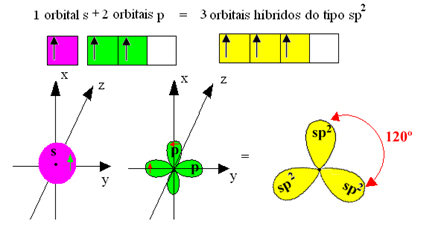
Visto que esses orbitais híbridos são formados por um orbital s e dois orbitais p, essa hibridização é chamada de Hibridização sp².
O flúor que se liga ao boro possui nove elétrons. Sua distribuição eletrônica e seus orbitais são mostrados a seguir:
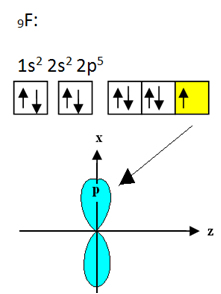
Veja que cada átomo de flúor pode realizar somente uma ligação covalente e que o orbital que realiza essa ligação é do tipo p. Assim, observe a seguir como fica a conformação dos orbitais ao se realizar as ligações que formam o BF3 e veja como as ligações são idênticas, do tipo σp-sp2:
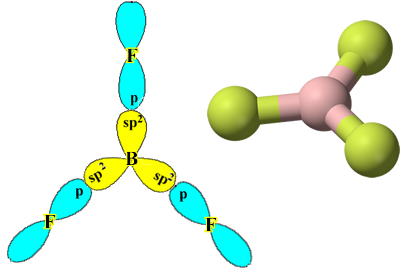
Isso também ocorre com outros elementos, veja, por exemplo, o texto “Hibridização do Berílio”.
Por Jennifer Fogaça
Graduada em Química

