Os carbonatos são compostos inorgânicos formados pela ligação iônica de um metal ou um semimetal com o ânion carbonato, CO32-.
O carbono é tetravalente, ou seja, ele possui quatro elétrons na camada de valência, podendo realizar quatro ligações covalentes para ficar estável, enquanto o oxigênio é bivalente, possuindo seis elétrons na camada de valência e podendo realizar duas ligações para ficar estável, com oito elétrons. Assim, existe uma forte tendência de um carbono se ligar a dois átomos de oxigênio, ficando todos estáveis (O ═ C ═ O → CO2).
Mas outro oxigênio pode se combinar com o carbono, visto que a relação dos raios iônicos leva ao número de coordenação igual a 3, formando uma estrutura triangular em que o carbono fica no centro, realizando uma dupla ligação com um dos átomos de oxigênio e duas ligações simples com os outros dois oxigênios. O resultado são dois elétrons em excesso, visto que esses dois oxigênios não ficam estáveis, necessitando de receberem ainda um elétron cada um:
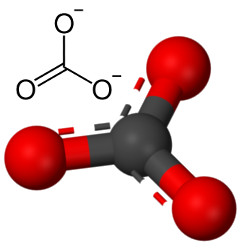
O ânion carbonato é formado por ligações covalentes, mas os seus compostos, que são os sais inorgânicos e os minerais conhecidos como carbonatos, são iônicos, pois esse radical recebe dois elétrons de algum metal ou semimetal, formando uma ligação iônica.
Esses compostos são insolúveis em água, com exceção do carbonato de amônio ((NH4)2CO3) e dos carbonatos formados com metais alcalinos (elementos da família 1: Li, Na, K, Rb, Cs e Fr). Quase todos são sólidos brancos, como mostra a imagem abaixo:

Os dois exemplos de carbonatos mais comuns e mais importantes do cotidiano são o carbonato de sódio (Na2CO3) e o carbonato de cálcio (CaCO3). No primeiro caso, o sódio é da família 1, possuindo um elétron na camada de valência e tendo a tendência de perder esse elétron para ficar estável. Como o ânion carbonato precisa receber dois elétrons, ele liga-se a dois átomos de sódio:

O carbonato de sódio é mais conhecido como soda ou barrilha, sendo usado na fabricação de sabões, corantes, remédios, papéis e no tratamento de água de piscina. Mas a sua principal aplicação é com o carbonato de cálcio e areia na fabricação de vidros.
O cálcio é da família 2, tendo a tendência de perder dois elétrons. Assim, um átomo de cálcio liga-se a um radical carbonato:

O carbonato de cálcio está presente no calcário e no mármore. As estalactites e estalagmites que existem em cavernas são constituídas desse carbonato; as conchas, os recifes de corais e as cascas de ovos também. Quando caiamos paredes, troncos de árvores e outros lugares, estamos usando o hidróxido de cálcio (Ca(OH)2), que, com o tempo, reage com o dióxido de carbono da atmosfera e forma o carbonato de cálcio.

Os carbonatos são muito comuns na superfície terrestre, como no caso dos minerais. Seus retículos cristalinos podem se rearranjar no espaço de duas formas: a ortorrômbica (como é o caso do mineral aragonita mostrado mais acima juntamente à fórmula do carbonato de cálcio) e o romboédrico ou trigonal, como é o caso da calcita (outro mineral constituído de carbonato de cálcio).
Os carbonatos reagem na presença de ácidos, liberando CO2, que é visto facilmente por meio de uma efervescência.
Por Jennifer Fogaça
Graduada em Química
