*Teoria de Arrhenius:
Baseado em seus experimentos com condutividade elétrica em meio aquoso, o químico, físico e matemático sueco Svante August Arrhenius (1859-1927) propôs, em 1884, os seguintes conceitos para definir ácidos e bases:

Assim, genericamente, temos:
H+ + H2O → H3O+
Exemplos:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NO3-
H2SO4+ 2H2O → 2H3O+ + SO42-

Exemplos:
NaOH → Na + + OH-
Ca(OH)2 →Ca2+ + 2 OH-
*Teoria de Brönsted-Lowry:
De forma independente, o dinamarquês Johannes Nicolaus Brönsted (1879-1947) e o inglês Thomas Martin Lowry (1874-1936), propuseram no mesmo ano outra teoria ácido-base conhecida como Teoria Brönsted-Lowry, que diz o seguinte:

Neste caso, considera-se como próton o íon hidrogênio. Isto é visto na reação a seguir, onde o ácido cianídrico doa um próton para a água, que atua, portanto, como base:
HCN + H2O → CN- + H3O+
Essa reação é reversível, sendo que o íon hidrônio (H3O+) pode doar um próton para o íon CN-. Desta forma, o íon hidrônio (H3O+) atua como ácido e o CN- como base.
CN- + H3O+→ HCN + H2O
*Teoria de Lewis:
Esta teoria foi criada pelo químico americano Gilbert Newton Lewis (1875-1946) e diz o seguinte:

Essa teoria introduz um conceito novo, é mais abrangente, mas não invalida a teoria de Brönsted-Lowry. Pois todo ácido de Lewis é um ácido de Brönsted, e consequentemente toda base de Lewis é uma base de Brönsted. Isto ocorre porque um próton recebe elétrons, ou seja, um ácido de Lewis pode unir-se a um par solitário de elétrons em uma base de Lewis.
Para Lewis, uma reação ácido-base consiste na formação de uma ligação covalente coordenada mais estável. Assim, quando uma base de Lewis doa um par de elétrons para uma base de Lewis, ambos formam uma ligação covalente coordenada, em que ambos os elétrons provém de um dos átomos, como ocorre no exemplo abaixo:
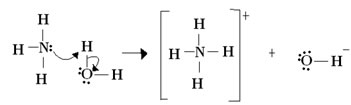
Nesse caso, a amônia atua como a base de Lewis e de Brönsted, pois ela doa os seus dois elétrons para o próton, sendo, portanto, a receptora do próton. Além disso, formou-se uma ligação covalente entre o hidrogênio (o próton) e a amônia.
Já a água é o ácido de Lewis e de Brönsted, pois ele doa o próton e recebe os elétrons, note como o oxigênio do hidróxido formado a partir da água ficou com um par de elétrons a mais.

Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola.


