O carbono é um não metal do 2º período do grupo 14 (família do carbono) da Tabela Periódica. Seu número atômico é 6, ou seja, possui seis prótons em seu núcleo, e seu peso atômico é 12,011 u. O elemento químico carbono é representado pela letra C.
Saiba mais: Origem da Tabela Periódica
Tópicos deste artigo
- 1 - Resumo sobre o carbono
- 2 - Onde o carbono é encontrado?
- 3 - Características e propriedades do carbono
- 4 - Ligações do carbono
- 5 - Ciclo do carbono
- 6 - Para que serve o carbono?
- 7 - Curiosidades sobre o carbono
Resumo sobre o carbono
- O carbono, de símbolo C, possui número atômico 6 e massa atômica igual a 12,011 u;
- O carbono é o elemento base da Química orgânica;
- Por ser tetravalente, o carbono é capaz de realizar quatro ligações químicas covalentes;
- A fotossíntese tem papel fundamental no ciclo do carbono;
- O carbono possui diversas aplicações, que vão desde combustíveis até joias, devido aos vários compostos que podem ser formados com esse elemento químico.
Onde o carbono é encontrado?
O carbono é um dos elementos que apresentam alotropia e, por isso, pode ser encontrado em diferentes formas, dependendo do alótropo em questão. Entre as formas alotrópicas do carbono, as mais conhecidas são o grafite e o diamante.
Além disso, o carbono pode ser encontrado ligado a outros elementos químicos, formando os mais diversos compostos. Por exemplo, quando ligado a dois átomos de oxigênio, forma a molécula do gás carbônico, CO2, presente nos ciclos de respiração celular e na fotossíntese das plantas.
Além disso, o carbono é o elemento base da Química orgânica, sendo objeto de estudo em diversas pesquisas, e está presente na constituição de compostos orgânicos naturais (como o DNA, as proteínas e os biocombustíveis), e de compostos sintéticos (como nylon, borrachas, plásticos e fármacos).
Veja também: Alotropia do carbono
Características e propriedades do carbono
Em todas as suas formas alotrópicas, carbono está no estado físico sólido, mas outras características físicas variam de estrutura para estrutura. Em relação à cor, o diamante é transparente e o carbono grafite é preto.
O carbono grafite é utilizado como eletrodos industriais, por ser um bom condutor de eletricidade, propriedade não encontrada no carbono diamante, por exemplo. O diamante é a substância de maior dureza já encontrada, enquanto o grafite possui uma dureza muito baixa.
Ligações do carbono
O carbono é um composto tetravalente, ou seja, é capaz de realizar quatro ligações químicas covalentes com outros átomos. Por exemplo, no gás metano, o átomo de carbono está ligado a quatro átomos de hidrogênio, resultando na formula molecular CH4.
.jpg)
As quatro ligações do carbono podem apresentar-se na forma simples, duplas ou triplas ligações, como mostramos a seguir:
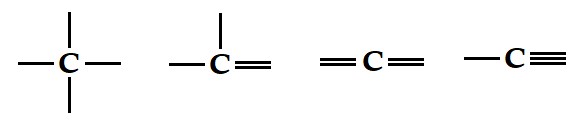
Devido ao seu baixo raio atômico, o carbono é capaz de formar diversas cadeias carbônicas, possibilitando a criação de diversos compostos, como é o exemplo dos combustíveis derivados de petróleo, formados, em sua maioria, por átomos de carbono e hidrogênio.
Leia também: Variação do raio atômico em ligações químicas
Ciclo do carbono
O ciclo do carbono tem início nas plantas e nos organismos que absorvem o gás carbônico disponível na atmosfera para realizarem o processo da fotossíntese. Nesse processo, o gás carbônico é convertido em gás oxigênio e açúcar (glicose, por exemplo), que a planta utiliza em seu crescimento.
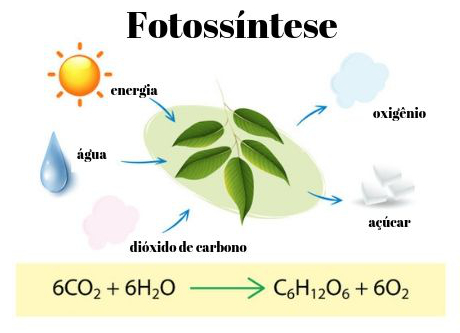
Quando os animais e as plantas consomem a glicose, o gás carbônico é novamente emitido na atmosfera pelo processo da respiração, deixando-o disponível para um novo processo de fotossíntese.
Esse ciclo pode ser representado pelas seguintes equações químicas, da fotossíntese e da respiração, respectivamente:
6 CO2 + 6 H2O + luz solar → C6H12O6 + 6 O2
C6H12O6 (matéria orgânica) + 6 O2 → 6 CO2+ 6 H2O + energia
A decomposição de matéria orgânica também libera CO2 na atmosfera, bem como a atividade humana, que, por meio de queima de combustíveis e incêndios (que consomem o carbono numa velocidade maior do que sua absorção), desregula o ciclo e causa danos ao meio ambiente. Caso tenha maior interesse nesse assunto, leia nosso texto: Ciclo do carbono.
Veja também: Ciclo do hidrogênio
Para que serve o carbono?
Devido à grande quantidade de compostos que possuem carbono em sua constituição, a quantidade dos seus usos é enorme. Confira a lista de alguns deles:
- Em combustíveis, como gasolina, diesel, gás natural e carvão;
- Na fabricação de lápis, eletrodos e lubrificantes (na forma de grafite);
- Na fabricação de joias e, por conta da sua dureza, em instrumentos industriais de corte, perfuração etc.;
- Em indústrias siderúrgicas (é adicionado à liga de ferro para dar maior resistência ao material, como é o exemplo do aço);
- Na datação de objetos encontrados em sítios arqueológicos (como isótopo radioativo do carbono, C-14).
Além dessas aplicações, o carbono pode servir para outras várias atividades, seja em indústrias e laboratórios, seja no nosso cotidiano.
Curiosidades sobre o carbono
Por ser um dos elementos mais versáteis, o carbono possui algumas singularidades:
- Cerca de 20% da massa do corpo humano são constituídos de carbono;
- São conhecidos mais compostos que possuem carbono em sua composição do que os que não o possuem;
- O carbono é o quarto elemento mais abundante no Universo;
- O material de maior dureza é o diamante, constituído exclusivamente de carbono;
- O isótopo do carbono C-12 é utilizado para calcular as massas atômicas dos outros elementos químicos.
Acesse também: Como transformar cabelo em diamante
.jpeg)