Reações de deslocamento, também denominadas reações de substituiçãoou ainda de simples troca, são aquelas que ocorrem quando uma substância simples (formada por um único elemento) reage com uma substância composta, “deslocando” essa última em uma nova substância simples.
Genericamente, podemos defini-la da seguinte maneira:
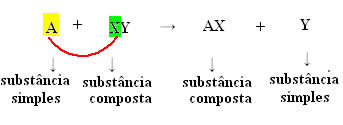
Mas, para que isso ocorra, a substância simples, no caso simbolizada por A, deve ser mais reativa que o elemento que será deslocado do composto, transformando-se em uma nova substância simples (Y).
Vejamos um exemplo em que essa reação ocorre:
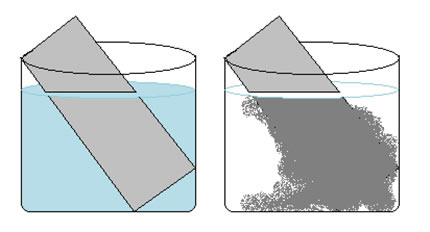
Observe o experimento abaixo em que se coloca uma lâmina de zinco (Zn) em uma solução aquosa de sulfato de cobre (CuSO4). Com o passar do tempo, nota-se que a solução de sulfato de cobre passa da coloração azul para um azul menos intenso, pois se descoloriu e houve um depósito de cobre sobre a lâmina de zinco.
Podemos representar essa reação por meio da seguinte equação química:

Note que o zinco deslocou o cobre, o que significa que o zinco é o mais reativo.
Visto que ambos são metais, podemos verificar se a reação de simples troca irá ocorrer ou não, analisando a fila de reatividade dos metais mostrada abaixo:

Observe que o cobre é realmente menos reativo que o zinco, portanto, se resolvêssemos fazer o contrário do experimento anterior e colocar uma lâmina de cobre em uma solução de sulfato de zinco, a reação não ocorreria, pois o cobre não conseguiria deslocar o zinco.
As reações de deslocamento são um tipo de reação de oxirredução, pois há transferência de elétrons da substância simples para a composta. No processo explicado anteriormente, o zinco estava inicialmente na sua forma neutra, que é a metálica, e passou a fazer parte de um composto em que ele apresenta a carga 2+, ou seja, cada átomo de zinco perdeu dois elétrons. Já com o cobre ocorre o contrário, ele recebe dois elétrons para passar para o estado metálico, sólido.
No caso de reação de simples troca com ametais, o mesmo é considerado: a reação só ocorrerá se o ametal mais reativo for a substância simples que poderá deslocar outro ametal menos reativo. A reatividade dos ametais é mostrada abaixo:

Por Jennifer Fogaça
Graduada em Química

