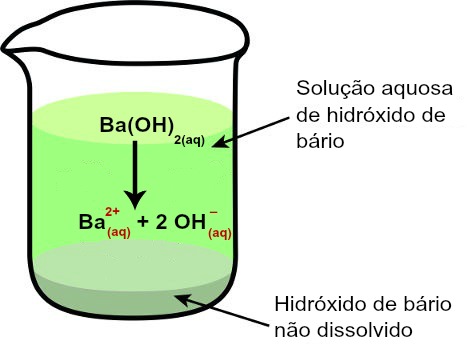
Segundo Arrhenius, as bases são substâncias que, quando dissolvidas em água, sofrem o fenômeno da dissociação, no qual ocorre a liberação de cátions e ânions. Isso acontece porque elas são iônicas, isto é, apresentam íons na sua constituição.
Ao se dissociar, uma base sempre libera um cátion diferente do hidrônio (H+) e um ânion hidroxila (OH-). O cátion liberado pertence ao grupo dos elementos metálicos, com exceção do amônio (NH4+).
A forma de representar uma dissociação é por meio de uma equação. De uma forma geral, as equações de dissociação das bases apresentam sempre os seguintes parâmetros:
-
base no reagente com a indicação aq (aquoso);
-
seta.
-
produto com um cátion qualquer (Y+) e um ânion (OH-)
YOH(aq) → Y+(aq) + OH-(aq)
Veja alguns exemplos:
Exemplo 1: Hidróxido de prata (AgOH)
Trata-se de uma base que apresenta o metal prata (Ag) associado ao grupo hidróxido (OH). Ao ser adicionada à água (aq), ocorre a liberação (dissociação) do cátion prata (Ag1+ - essa carga deve-se à presença de um grupo hidroxila (OH) na fórmula da base) e de um ânion hidroxila (OH-). Assim, podemos escrever a equação de dissociação da seguinte maneira:
AgOH(aq) → Ag+(aq) + 1 OH-(aq)
Exemplo 2: Hidróxido de rádio [Ra(OH)2]
Trata-se de uma base que apresenta o metal rádio (Ra) associado ao grupo hidróxido (OH). Ao ser adicionada à água (aq), ocorre a liberação (dissociação) do cátion rádio (Ra2+ - essa carga deve-se à presença de dois grupos hidroxila (OH) na fórmula da base) e de dois mols do ânion hidroxila (OH-). Assim, podemos escrever a equação de dissociação da seguinte maneira:
Ra(OH)2 (aq) → Ra2+(aq) + 2 OH-(aq)
Exemplo 3: Hidróxido de cobalto III [Co(OH)3]
Trata-se de uma base que apresenta o metal cobalto (Co) associado ao grupo hidróxido (OH). Ao ser adicionada à água, ocorre a liberação (dissociação) do cátion cobalto (Co3+ - essa carga deve-se à presença de três grupos hidroxila (OH) na fórmula da base) e de três mols do ânion (OH-). Assim, podemos escrever a equação de dissociação da seguinte maneira:
Co(OH)3 (aq) → Co3+(aq) + 3 OH-(aq)
Exemplo 4: Hidróxido de estanho IV [SnOH)4]
Trata-se de uma base que apresenta o metal estanho (Sn) associado ao grupo hidróxido (OH). Ao ser adicionada à água, ocorre a liberação (dissociação) do cátion estanho (Sn4+ - essa carga deve-se à presença de quatro grupos hidroxila (OH) na fórmula da base) e de quatro mols do ânion (OH-). Assim, podemos escrever a equação de dissociação da seguinte maneira:
Sn(OH)4 (aq) → Sn4+(aq) + 4 OH-(aq)
Exemplo 5: Hidróxido de arsênio V [As(OH)5]
Trata-se de uma base que apresenta o metal arsênio (As) associado ao grupo hidróxido (OH). Ao ser adicionada à água, ocorre a liberação (dissociação) do cátion arsênio (As5+, essa carga deve-se à presença de cinco grupos hidroxila (OH) na fórmula da base) e de cinco mols do ânion (OH-). Assim, podemos escrever a equação de dissociação da seguinte maneira:
As(OH)5 (aq) → As5+(aq) + 5 OH-(aq)
Por Me. Diogo Lopes Dias