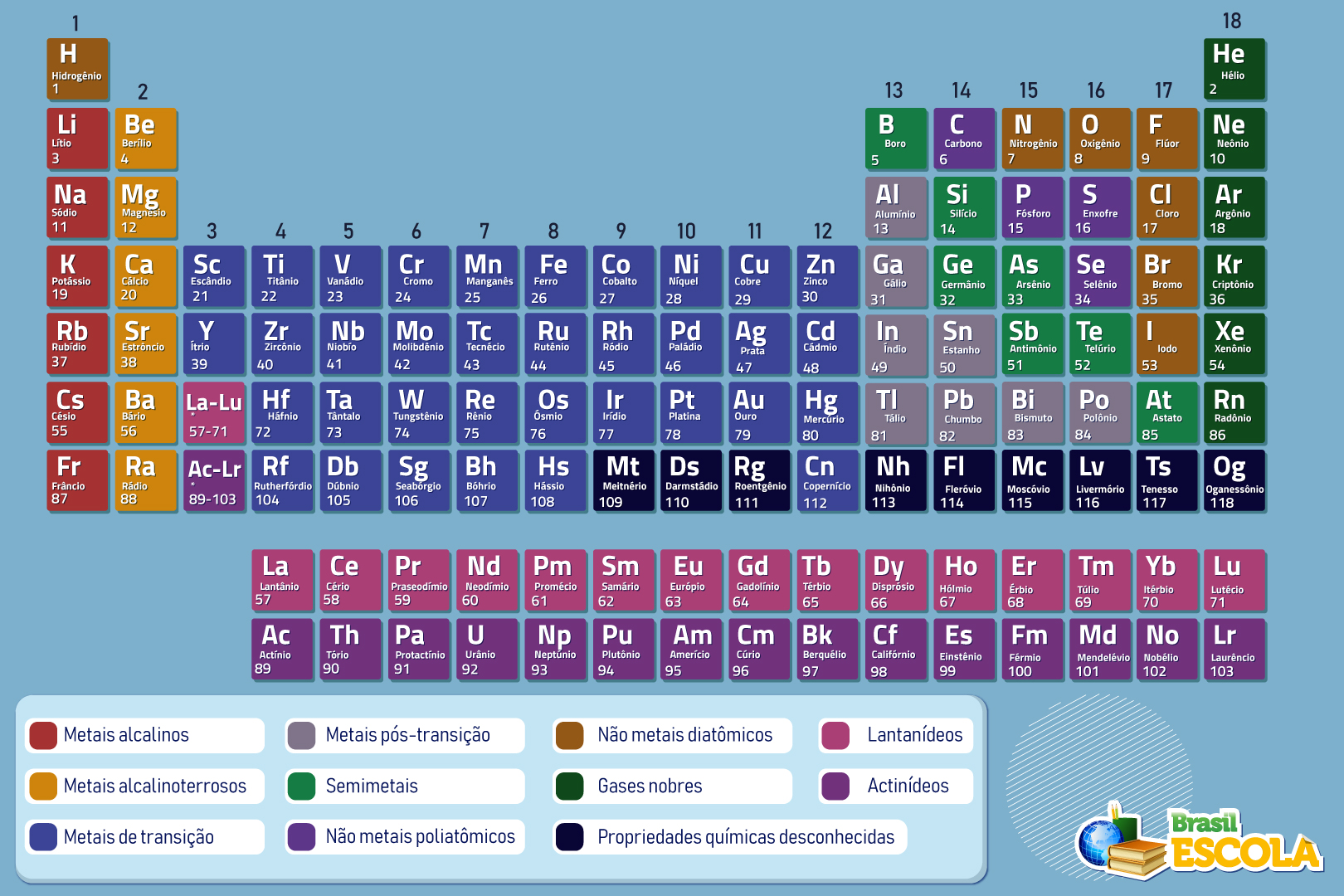
Baixe a Tabela Periódica em PDF!
A Tabela Periódica é uma ferramenta que tem por objetivo organizar e agrupar todos os elementos químicos já descobertos pelo ser humano. Foi desenvolvida em 1869 pelo químico russo Dmitri Mendeleev, o qual organizou elementos de propriedades semelhantes em grupos e os colocou em ordem crescente de massa.
Posteriormente, em 1913, a Tabela Periódica foi aprimorada pelo físico inglês Henry Moseley, depois de seu método de determinação dos números atômicos. Dali em diante, os elementos foram colocados em ordem crescente de números atômicos, tomando a forma que hoje conhecemos. Em comemoração aos 150 anos da criação da Tabela Periódica, a Organização das Nações Unidas decretou o ano de 2019 como o Ano Internacional da Tabela Periódica.
Leia também: Quais são os elementos radioativos?
Tópicos deste artigo
- 1 - Resumo sobre a Tabela Periódica
- 2 - Videoaula sobre a Tabela Periódica
- 3 - Organização da Tabela Periódica
- 4 - Propriedades periódicas
- 5 - Mapa Mental: Tabela Periódica
- 6 - Origem e história da Tabela Periódica
- 7 - Curiosidades sobre a Tabela Periódica
Resumo sobre a Tabela Periódica
-
A Tabela Periódica organiza todos os elementos já descobertos pelos seres humanos.
-
Os elementos químicos são colocados em ordem crescente de número atômico.
-
Nas suas colunas, chamadas de grupos, estão os elementos com propriedades físico-químicas semelhantes.
-
Nas suas linhas, chamadas de períodos, está indicada a camada eletrônica mais energética do elemento.
Anuncie aqui -
A Tabela tem várias subdivisões, diferenciando os elementos em metal ou ametal, representativos ou de transição, além de subdividi-los de acordo com sua distribuição eletrônica.
-
A Tabela Periódica foi desenvolvida pelo químico russo Dmitri Mendeleev, em 1869, e foi sendo aprimorada ao longo dos anos até sua forma atual.
Videoaula sobre a Tabela Periódica
Organização da Tabela Periódica
A Tabela Periódica tem grande utilidade porque consegue estabelecer padrões de organização para todos os elementos químicos descobertos pela humanidade até então. Atualmente são 118 elementos químicos, os quais são dispostos na Tabela em ordem crescente de números atômicos, da esquerda para a direita, iniciando no hidrogênio (número atômico igual a 1) e terminando no recém-incluído oganessônio (número atômico igual a 118).
Contudo, a grande vantagem da Tabela Periódica é colocar elementos de propriedades físico-químicas semelhantes na mesma coluna. As colunas da Tabela podem ser chamadas de grupos ou família. Já as linhas, que dispõem os elementos em ordem crescente de número atômico, são chamadas de períodos.
-
Famílias ou grupos
A Tabela Periódica conta com 18 linhas verticais (ou colunas), as quais podem ser chamadas de famílias ou grupos. Em cada coluna, estão dispostos elementos de propriedades físico-químicas semelhantes. A única exceção é o elemento químico hidrogênio, que, apesar de estar no grupo 1, não possui propriedades semelhantes aos demais.
Podemos citar os elementos de uma família apenas falando seu número, como família (ou grupo) 1 ou família (ou grupo) 2, ou então citando o nome do seu primeiro elemento, como família (ou grupo) do ferro, família (ou grupo) do carbono.
Contudo, alguns grupos trazem nomes famosos, criados antes do desenvolvimento da Tabela Periódica. São eles:
-
Metais alcalinos (grupo 1, com exceção do hidrogênio)
-
Pinictogênios (grupo 15)
-
Calcogênios (grupo 16)
-
Halogênios (grupo 17)
Anuncie aqui -
Gases nobres (grupo 18)
Ainda se difunde bastante a separação dos grupos em A e B. Contudo, a União Internacional da Química Pura e Aplicada (Iupac) não recomenda mais a utilização dessa separação, devendo-se utilizar então os números 1 até 18 para representar as famílias ou os grupos. Isso porque a Iupac utilizava as letras A e B para separar o lado esquerdo (A) do lado direito (B) da Tabela, usando os grupos de ferro, cobalto e níquel como fronteira.
Contudo, o sistema americano CAS utilizou a letra A para indicar elementos representativos e a letra B para indicar elementos de transição. Consequentemente, essas denominações trouxeram muita confusão, e a Iupac interviu para sanar esse problema.
Também tem não se recomenda mais a utilização do termo família como sinônimo de grupo, contudo, essa associação ainda é muito difundida em materiais didáticos e por isso foi citada.
-
Períodos
Os períodos são as linhas horizontais na Tabela Periódica e colocam os elementos em ordem crescente de número atômico. Atualmente, a Tabela conta com sete períodos, ou seja, do primeiro ao sétimo. Eles indicam em qual camada está o elétron mais energético do elemento químico correspondente.
Um detalhe importante é acerca dos lantanídeos e actinídeos. O lantânio, La, número atômico 57, pertence ao sexto período da Tabela Periódica, estando na família 3 (do escândio, Sc). Os outros 14 elementos que vêm após ele, do cério (Ce, número atômico 58) ao lutécio (Lu, número atômico 71), são chamados de lantanídeos.
Assim como o actínio (Ac, número atômico 89) encontra-se no sétimo período, na família 3 também, os outros 14 elementos que vêm após ele, do tório (Th, número atômico 90) até o laurêncio (Lr, número atômico 103), são chamados de actinídeos. Teoricamente a Tabela Periódica deveria se estender horizontalmente para agrupar tanto os lantanídeos quando os actinídeos, contudo, para melhor visualização, a ela é geralmente encurtada, colocando essas duas séries embaixo dela.
Também existem outras divisões na Tabela Periódica, como a distribuição em metais e ametais. Antigamente existia a subclasse dos semimetais ou metaloides, contudo, a Iupac deixou de utilizar essa subclasse, dividindo os elementos participantes entre metal e ametal.
A divisão entre elementos representativos e de transição ainda se mantém. Contudo, algo geralmente pouco lembrado entre os estudantes é que os representativos são apenas os elementos dos grupos 1, 2, 14, 15, 16, 17 e 18, excluindo-se o hidrogênio. Já os elementos de transição são os dos grupos 3 ao 11, excetuando-se o grupo 12.
Isso porque a definição de elemento de transição indica que tal elemento deve possuir um subnível d incompleto ou formar cátion com subnível d incompleto. Todos os elementos do grupo 12 possuem subnível d completo (d10) e, ao formarem cátions (sempre bivalentes), mantêm o subnível d completo. Contudo, alguns autores mantêm os elementos do grupo 12 entre os elementos de transição. Há, ainda, a subdivisão de elementos de transição interna (lantanídeos e actinídeos) e externa (demais elementos de transição).
|
Sistema Iupac em vigor para classificação de grupos |
Denominação dos elementos de acordo com os grupos |
|
Grupo 1 |
Elementos representativos |
|
Grupo 2 |
|
|
Grupo 3 |
Elementos de transição |
|
Grupo 4 |
|
|
Grupo 5 |
|
|
Grupo 6 |
|
|
Grupo 7 |
|
|
Grupo 8 |
|
|
Grupo 9 |
|
|
Grupo 10 |
|
|
Grupo 11 |
|
|
Grupo 12 |
- |
|
Grupo 13 |
Elementos representativos |
|
Grupo 14 |
|
|
Grupo 15 |
|
|
Grupo 16 |
|
|
Grupo 17 |
|
|
Grupo 18 |
Também se utiliza a distribuição eletrônica para separar os elementos da Tabela Periódica.
-
Os grupos 1 e 2, além do hélio (He), pertencem ao bloco s, pois possuem subnível s como subnível de valência.
-
Os grupos 13 a 18 pertencem ao bloco p, pois possuem esse subnível como subnível de valência.
-
Os grupos 3 a 12 contemplam o bloco d, pois esses elementos terminam sua configuração eletrônica sempre em ns2(n-1)dx, em que n é o número do período do elemento e x é o número de elétrons no subnível d.
-
Já os lantanídeos e actinídeos fazem parte do bloco f, pois eles terminam a configuração sempre em ns2(n-1)d1(n-2)fy, em que n é o número do período do elemento e y é o número de elétrons no subnível f.
Veja também: Quais são os novos elementos da Tabela Periódica?
Propriedades periódicas
Uma das grandes vantagens da Tabela Periódica são as propriedades periódicas. Quando organizamos os elementos tal como fizeram Mendeleev ou Moseley, percebemos que ocorre uma periodicidade dessas propriedades, o que quer dizer que elementos com propriedades semelhantes se repetem regularmente.
São propriedades periódicas:
-
Raio atômico: é uma propriedade utilizada para dimensionar o tamanho dos átomos. Quanto mais à esquerda e mais abaixo, maior o raio do elemento. Assim, o frâncio (Fr) é o elemento de maior raio. Contudo, os elementos do quinto e sexto períodos do bloco d possuem raios semelhantes, por conta de um efeito que ocorre nos lantanídeos chamado de contração lantanídica ou contração lantânica. Tal fenômeno, causado pela menor eficiência de blindagem dos subníveis f, faz com que haja um decréscimo no raio atômico do cério (Ce) ao lutécio (Lu), fazendo com que elementos como prata (Ag) e ouro (Au) ou paládio (Pd) e platina (Pt) tenham raios atômicos de tamanhos semelhantes.
-
Energia (ou potencial) de ionização: é a energia necessária para se retirar um elétron de valência de um átomo isolado no estado gasoso. Quanto menor for o átomo, mais difícil será a retirada do elétron de valência, pois mais próximo ao núcleo estará esse elétron.
-
Afinidade eletrônica ou eletroafinidade: é a variação de energia quando um elétron se liga a um átomo isolado na fase gasosa. Caso muita energia seja liberada nesse processo, isso significa que o átomo tem grande afinidade ou atração por elétrons. De modo geral, átomos menores têm maior afinidade eletrônica.
-
Eletronegatividade: a habilidade de um átomo em atrair elétrons para si em uma ligação química. Quanto menor o átomo, maior a eletronegatividade.
-
Densidade: o elemento mais denso da Tabela Periódica é o ósmio (Os), assim, a densidade dos elementos aumenta quanto mais próximos do ósmio eles estão. A densidade não faz referência à massa do átomo dividida por seu raio atômico, mas sim à sua substância simples mais estável.
Anuncie aqui -
Pontos de fusão e ebulição: o elemento de maior ponto de fusão é o tungstênio (W), enquanto o de maior ponto de ebulição é o rênio (Re). Quanto mais próximo o elemento for desses átomos, maiores serão seus pontos de fusão e ebulição. A única exceção são os metais alcalinos e alcalino-terrosos, cujos pontos de fusão e ebulição aumentam com a diminuição do tamanho do átomo.
Mapa Mental: Tabela Periódica
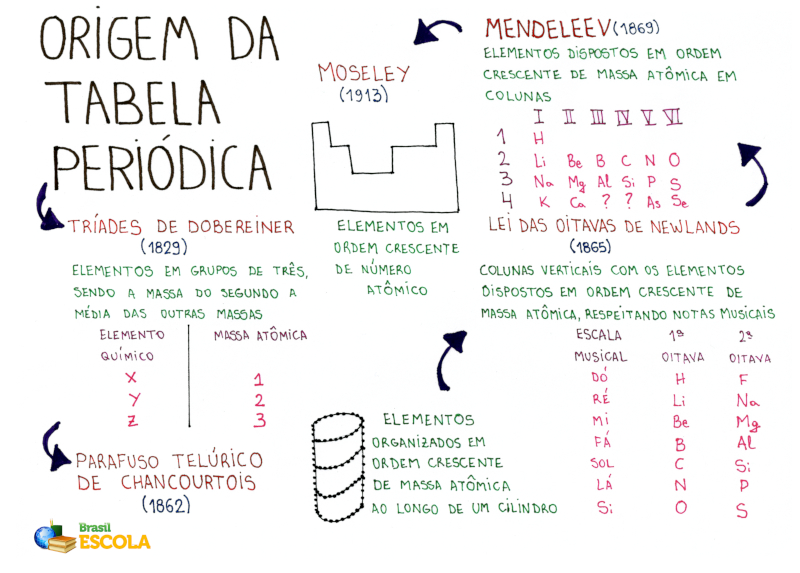
* Baixe o mapa mental sobre a Tabela Periódica!
Origem e história da Tabela Periódica
Embora a criação da Tabela Periódica seja creditada a Dmitri Mendeleev, o químico russo foi bastante influenciado por diversos cientistas.
Antoine-Laurent Lavoisier, na sua célebre obra Tratado elementar de química, de 1789, listava 33 elementos, gases, metais, não metais e elementos terrosos. Posteriormente, Lavoisier retirou alguns desses elementos, classificando-os como compostos, assim como retirou a luz, que não fez mais parte dessa classificação. Contudo, 25 dos elementos de Lavoisier se encontram na Tabela Periódica atual.
Posteriormente, Johann Wolfgang Döbereiner apresentou, em 1817, a chamada lei das tríades, em que agrupava trios de elementos de acordo com suas propriedades químicas, de modo que o elemento do meio tivesse uma massa atômica que fosse aproximadamente a média aritmética dos outros dois.
Em 1862, Alexandre-Émile Béguyer de Chancourtois desenvolveu a classificação tridimensional conhecida como parafuso telúrico, em que organizava os elementos em uma hélice e em ordem crescente de massa atômica. Fato é que Chancourtois percebeu propriedades periódicas em seu agrupamento, porém o geólogo teve dificuldade na difusão de suas ideias, não só pelo fato do modelo ser tridimensional, mas também por sua linguagem ser diferente da comumente utilizada pelos químicos.
A lei das oitavas surgiu posteriormente, proposta por John Newlands, em 1863. Newlands organizou os elementos de propriedades semelhantes em 11 grupos, e, além disso, tais propriedades se repetiam após oito elementos. O nome oitavas faz referência às oitavas musicais.
Embora, inicialmente, seu trabalho tenha sido considerado vago e confuso, posteriormente Newlands foi premiado por ele, em 1887, ao receber a Medalha Davy da Real Sociedade de Londres. Contudo, tais modelos sempre apresentavam lacunas e não conseguiam abranger todos os elementos já conhecidos.
Foi então que, em 1860, no Congresso de Karlsruhe, 129 químicos se reuniram para padronizar formas de nomear e conceituar os conteúdos de pesquisas químicas, diferenciando termos como átomo e molécula. Stanislao Cannizzaro, um dos palestrantes do congresso, apresentou um estudo sobre um novo sistema de massas atômicas, entregando cópias de seu artigo aos presentes.
Dmitri Mendeleev e Julius Lothar Meyer estavam entre os presentes, e então receberam uma cópia do trabalho de Cannizzaro. Por meio das ideias deste, Meyer desenvolveu uma Tabela com 28 dos 56 elementos já conhecidos e, em 1868, trabalhou em uma Tabela Periódica que incluía todos os elementos químicos conhecidos. Em 1869, contudo, Mendeleev publicou então sua Tabela Periódica.
Sem dúvida alguma, a proximidade das publicações gerou conflitos, tanto que, em 1892, a Real Sociedade de Londres premiou ambos com a Medalha Davy. Contudo, a Tabela de Mendeleev vigorou, pois previa a existência de elementos ainda não descobertos, deixando espaços vazios, e, além disso, ao incluir elementos conhecidos e desconhecidos, levava em consideração diversas propriedades físicas e químicas, podendo, inclusive, antever quais seriam as propriedades dos elementos a serem descobertos.
Contudo, a Tabela Periódica de Mendeleev é um instrumento de pesquisa e aberta a constantes revisões. O próprio Mendeleev realizou alterações posteriormente ao incluir um oitavo grupo, que ele chamou de elementos de transição, por conta de uma quebra de periodicidade acarretada pela inclusão do ferro. William Ramsay, no final do século XIX, acrescentou à Tabela os gases nobres, enquanto Alfred Werner deu a ela uma cara mais próxima da que conhecemos ao incluir o bloco d, formando uma série de transição.
Os trabalhos de Henry Moseley, em 1913, rearranjaram a Tabela Periódica, uma vez que ele enunciou a lei periódica, afirmando que “as propriedades físicas e químicas dos elementos são funções periódicas de seus números atômicos”. Criou-se então o conceito de número atômico, em que cada elemento teria seu próprio número, fazendo com que a Tabela agora fosse organizada em ordem crescente de números atômicos.
Os trabalhos de Moseley tiraram as últimas lacunas de Mendeleev. Após isso, na década de 1950, McMillan e Seaborg descobriram os elementos transurânicos, aqueles com número atômico maior que 92, reconfigurando a Tabela Periódica e, assim, incluindo os lantanídeos e actinídeos.
Desde então, a Tabela Periódica sofre pequenas inclusões de alguns elementos que vão sendo descobertos, sendo o último a ser incluído o elemento 118, oganessônio (Og), com os elementos tenesso (Ts), moscóvio (Mc) e nihônio (Nh).
Quem determina a estrutura oficial e padrão da Tabela Periódica atualmente é a Iupac, assim como é esse órgão que regulariza as mudanças que ela deve sofrer.
Curiosidades sobre a Tabela Periódica
-
Mendeleev previu a existência de elementos ainda não descobertos bem como suas propriedades. Foi o caso do germânio (Ge), o qual ele chamou de eka-silício.
-
J é a única letra do alfabeto que não está presente na Tabela Periódica.
Anuncie aqui -
Diz-se que Mendeleev buscou inspiração no jogo Paciência para montar sua Tabela Periódica.
-
O Guiness Book coloca o plutônio (Pu) como o elemento mais perigoso da Tabela Periódica, uma vez que é altamente radioativo e é utilizado na confecção de bombas atômicas.
-
A versão original da Tabela de Mendeleev foi perdida.
-
Quando o argônio foi descoberto, em 1894, ele não se encaixava em nenhum grupo da Tabela de Mendeleev. Como consequência, o químico russo negou a existência desse elemento.