O hipoclorito de sódio (NaClO) é um composto inorgânico que, comercialmente, apresenta-se como um líquido amarelo esverdeado, cuja principal atuação é como solução alvejante e desinfetante. Tem boa solubilidade e estabilidade em água e, na forma de uma solução aquosa, apresenta um odor característico de gás cloro.
O hipoclorito de sódio é utilizado, principalmente, como solução alvejante e desinfetante, sendo o princípio ativo da água sanitária. Tem grande capacidade germicida, fungicida e bactericida, graças à formação do HClO em pH adequado. Contudo, é um composto altamente perigoso, dado seu alto poder oxidante, necessitando de cuidados na manipulação.
Tópicos deste artigo
- 1 - Resumo sobre hipoclorito de sódio (NaClO)
- 2 - O que é hipoclorito de sódio (NaClO)?
- 3 - Propriedades do hipoclorito de sódio (NaClO)
- 4 - Características do hipoclorito de sódio (NaClO)
- 5 - Para que serve o hipoclorito de sódio (NaClO)?
- 6 - Diferenças entre hipoclorito de sódio e água sanitária
- 7 - Precauções com o hipoclorito de sódio (NaClO)
Resumo sobre hipoclorito de sódio (NaClO)
- O hipoclorito de sódio, NaClO, apresenta-se comercialmente como uma solução amarelo esverdeada, com forte odor de gás cloro.
- Tem boa solubilidade em água e grande poder oxidante.
- É principalmente utilizado como desinfetante e alvejante, sendo o princípio ativo, por exemplo, da água sanitária.
- Na diluição adequada de produtos de hipoclorito de sódio, ocorre a formação de ácido hipocloroso, HClO, que tem grande poder oxidante e desinfetante.
- É um composto altamente perigoso, muito por consequência do seu alto poder oxidante, exigindo a utilização de equipamentos de proteção durante sua manipulação.
O que é hipoclorito de sódio (NaClO)?

O hipoclorito de sódio é um composto inorgânico pertencente ao grupo dos sais e cuja fórmula é NaClO (alguns autores também usam NaOCl). É comumente visto na forma de um líquido amarelo esverdeado, com aroma característico do gás cloro.
Propriedades do hipoclorito de sódio (NaClO)
O hipoclorito de sódio anidro apresenta uma massa molar de 74,442 g/mol, sendo estável em solução aquosa e com grande solubilidade (79,9 g para cada 100 g de H2O). Contudo, fora da solução aquosa, na sua forma anidra, é instável, podendo se decompor explosivamente, não apresentando dados referentes à densidade e temperaturas de mudança de fase nessa forma.
Porém, numa solução aquosa de concentração 5,5% em massa, o hipoclorito de sódio apresenta uma densidade de 1,1 g/mL. Pode também ser cristalizado na forma penta-hidratada, NaClO∙5H2O, estável se mantida sob refrigeração, e apresenta um ponto de fusão de 18 °C e uma densidade de 1,6 g/mL.
Características do hipoclorito de sódio (NaClO)
Comercialmente, o hipoclorito de sódio se apresenta como uma solução de coloração amarelo esverdeada, a qual não apresenta aspecto turvo. O que chama a atenção é o seu odor característico de gás cloro, Cl2. O gás cloro é gerado por conta da instabilidade da solução comercial, e, a depender do grau de pureza, a produção de Cl2 pode ser mais rápida. Dentre os fatores que facilitam a decomposição da solução comercial, podemos citar a exposição à luz e ao calor, o contato com ácidos e a presença de íons metálicos, capazes de quebrar o grupo hipoclorito.
O hipoclorito de sódio é um oxidante forte e, assim sendo, reage vigorosamente com compostos inflamáveis e substâncias redutoras. Além disso, é uma base fraca, porém altamente reativa, sendo capaz de alimentar e gerar combustões perigosas.
As soluções comerciais de hipoclorito costumam ter a presença de hidróxido de sódio, NaOH, o que faz o pH ser elevado e maior que 12. Quando dissolvido em água, o hipoclorito de sódio acaba sendo decomposto em dois compostos similares, muito atrelados ao mecanismo de desinfecção dessa substância (o seu principal uso): o ácido hipocloroso, HClO, altamente desinfetante, e o ânion hipoclorito, ClO−, com menor poder desinfetante. A proporção HClO/ClO− é consequência direta do pH.
O hipoclorito de sódio tem duas rotas principais de produção: a química e a eletroquímica.
Na rota química, o gás cloro reage com o hidróxido de sódio, formando NaClO, NaCl (cloreto de sódio) e água.
Cl2 (g) + 2 NaOH (aq) → NaClO (aq) + NaCl (aq) + H2O (l)
Já no processo eletroquímico, que parte de uma solução aquosa de NaCl, há a formação de uma solução alcalina de NaClO. A eletrólise de uma solução aquosa de NaCl produz gás cloro, gás hidrogênio (H2) e uma solução aquosa de hidróxido de sódio.
2 NaCl (aq) + 2 H2O (l) → Cl2 (g) + H2 (g) + 2 NaOH (aq)
Na célula eletrolítica, há uma membrana que impede que o gás cloro formado no ânodo entre em contato com a solução aquosa de NaOH, a qual se acumula no compartimento do cátodo. A partir do momento que essa separação é retirada, os produtos da eletrólise aquosa do NaCl reagem e formam NaClO, numa reação muito semelhante ao método químico de produção. O íon sódio é espectador, ou seja, não participa da reação (é um eletrólito forte), porém será representado para fins didáticos.
Cl2 (g) + 2 Na+ (aq) + 2 OH− (aq) → 2 Na+ (aq) + ClO− (aq) + Cl− (aq) + H2O (l)
Para que serve o hipoclorito de sódio (NaClO)?
A maior utilização do hipoclorito de sódio é na produção de alvejantes, como a popular “água sanitária”, que consiste em uma solução de 2% a 2,5% de NaClO. Assim sendo, está presente em diversos produtos de limpeza caseiros e aditivos de lavanderia, com a função de desinfetante, removedor de manchas e branqueador.
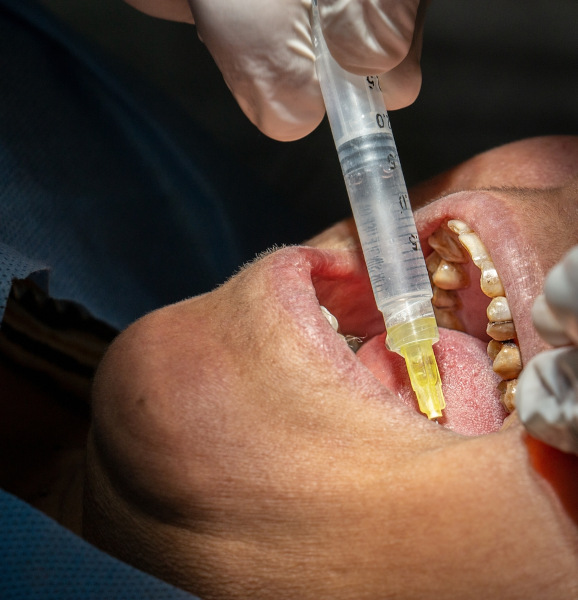
Outras utilizações incluem o tratamento de água, para prevenção de doenças como cólera e febre tifoide, a esterilização em fábricas de alimentos e a higienização hospitalar. Na odontologia, é usado como solução irrigadora para uso em canais radiculares infectados. Pode ser usado também para fabricação de papel e como precursor para a síntese de outros produtos químicos.

Especificamente falando da sua utilização em produtos desinfetantes, devemos citar que, ao se adicionar NaClO em água, temos a produção de HClO, conforme a reação:
NaClO + H2O → HClO + NaOH
O HClO se decompõe em ácido clorídrico, HCl, e em oxigênio nascente, , uma forma altamente oxidante do oxigênio.
HClO → HCl +
É essa forma de oxigênio que atua sobre microrganismos, como germes, bactérias, vírus e fungos, sendo letal. O HClO tem uma estrutura muito similar à àgua e, por conta disso, pode facilmente passar pelas membranas de células patogênicas.
Por isso, produtos contendo cloro ativo, como água sanitária, procuram aumentar a produção de HClO. A maior produção de HClO ocorre em um menor pH, já que a maior concentração de H+ no meio não favorece a ionização do ácido hipocloroso.
Contudo, em baixo pH, a estabilidade da solução de NaClO é baixa e, portanto, é comum a utilização de hidróxido de sódio para elevar o pH para valores acima de 10, o que acaba diminuindo a formação de HClO no meio e prejudicando a efetividade da desinfecção.
Por isso, produtos como a água sanitária só se tornam efetivos mediante diluição com água, pois isso diminui a concentração de íons OH− e, assim, faz cair o pH. O ideal é que esse pH fique entre 6,5 e 8,5 para que a seguinte reação ocorra:
ClO− (aq) + H+ (aq) + OH− (aq) → HOCl (aq) + OH− (aq)
Contudo, se o pH decair muito, o ácido hipocloroso poderá reagir com os íons de cloro que estão livres na solução, com a consequente formação de gás cloro, tóxico.
HClO (aq) + H+ (aq) + Cl− (aq) → Cl2 (g) + H2O (l)
Daí a importância de seguir as orientações do fabricante para uma diluição adequada do produto e não o misturar com outros produtos químicos inadvertidamente.
Acesse também: Cloreto de sódio (NaCl) — detalhes sobre o sal de cozinha
Diferenças entre hipoclorito de sódio e água sanitária
O hipoclorito de sódio é o princípio ativo da água sanitária, uma solução aquosa de 2% a 2,5% desse composto. Assim sendo, embora no dia a dia pareçam sinônimos, não o são. Nem toda solução de hipoclorito de sódio é água sanitária e nem todo hipoclorito de sódio é utilizado para fabricação de água sanitária. Contudo, é inegável que a água sanitária é um dos produtos mais conhecidos de NaClO, dada sua facilidade de aquisição, difusão e baixo custo.
Precauções com o hipoclorito de sódio (NaClO)
O hipoclorito de sódio que manipulamos no cotidiano merece bastante atenção, justamente por ser uma solução bastante oxidante e corrosiva.
Seu contato com a pele e mucosas pode gerar irritações severas, podendo, inclusive, causar queimaduras na pele e nos olhos. A inalação de solução de hipoclorito de sódio pode causar irritações nas vias respiratórias e na garganta, além de irritação nos pulmões. Uma inalação mais acentuada pode gerar um edema pulmonar (formação de líquidos nos pulmões). Outros efeitos citados são dores de cabeça, confusão mental, náusea e vômito.
Por isso, deve-se ter atenção à sua manipulação, mediante uso de equipamentos de proteção individual, como luvas, óculos de proteção e máscaras, além de manter o ambiente altamente ventilado durante sua utilização.

Além disso, apesar do hipoclorito de sódio não ser inflamável, seu alto poder oxidante pode intensificar a combustão de outros produtos.
Crédito de imagem
Fontes
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
PONZANO, G. P. Sodium Hypochlorite: History, Properties, Electrochemical Production. In: Disinfection by Sodium Hypochlorite: Dialysis Applications. Contributions to Nephrology. v. 154, p. 7-23. Basileia, Suíça: Karger, 2007.

