Os sulfatos são compostos iônicos que contêm o ânion SO42-, que é chamado de ânion sulfato.
O enxofre é um elemento da família 16 ou VI-A, o que significa que ele possui 6 elétrons na sua camada de valência. Segundo a regra do octeto, ele precisaria receber mais 2 elétrons para ficar com 8 elétrons na última camada eletrônica e assim ficar estável. Mas o enxofre sofre expansão do octeto, visto que ele é um elemento situado no terceiro período da Tabela Periódica, sendo relativamente grande, o que permite que ele possa acomodar mais de oito elétrons ao seu redor.
Assim, conforme se pode visualizar abaixo, o nível de valência do enxofre expande-se para abrigar um total de 12 elétrons. Mas dois átomos de oxigênio ainda não ficam estáveis, ficando cada um com sete elétrons na camada de valência, precisando, assim, ainda receberem mais um elétron para estabilizarem-se. Por essa razão, a carga de cada um desses dois átomos é -1, resultando em uma carga total para o ânion de -2:
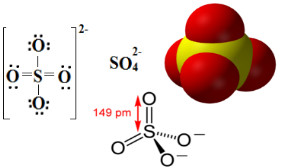
O ânion sulfato pode ser proveniente do ácido sulfúrico (H2SO4(aq)) mostrado abaixo:
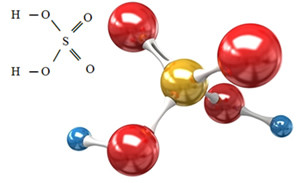
O ácido sulfúrico reage com alguma base, em uma reação de neutralização, formando um sal inorgânico, que é o nosso sulfato, e também água:
Reação genérica: Ácido sulfúrico + Base → Sal (sulfato) + Água
H2SO4 + 2 COH → C2SO4 + 2 H2O
Veja um exemplo abaixo em que é formado o sulfato de potássio:
H2SO4 + 2 KOH → K2SO4 + 2 H2O
Observe que a nomenclatura de um sulfato é feita simplesmente pela regra: sulfato de + nome do elemento ligado a ele. Além disso, as fórmulas dos sulfatos são feitas trocando-se a carga de cada íon pelo índice do elemento, sendo que o índice “1” não precisa ser escrito:
Exemplos:
Na+1 SO42- → Na2SO4→ sulfato de sódio
Mg+2 SO42- → MgSO4→ sulfato de magnésio
Ca+2 SO42- → CaSO4→ sulfato de cálcio
Ba+2 SO42- → BaSO4→ sulfato de bário
Al+3 SO42- → Al2(SO4)3→ sulfato de alumínio
Os sais que contêm o íon sulfato costumam ser solúveis em água, sendo que as exceções são quatro: sulfato de cálcio (CaSO4), sulfato de estrôncio (SrSO4), sulfato de bário (BaSO4) e sulfato de chumbo (PbSO4). Isso ocorre porque existe uma elevada energia de ligação entre esses cátions (Ca2+, Sr2+, Ba2+ e Pb2+) e o sulfato, visto que todos eles possuem carga +2 e o ânion sulfato possui carga -2. Assim, o rompimento dessa ligação torna-se mais difícil.
Os sulfatos são encontrados na forma de retículos cristalinos, em razão da atração que as cargas opostas exercem umas sobre as outras, como mostrado abaixo no caso do sulfato de cobre (CuSO4):
.jpg)
Os sulfatos encontram-se na natureza principalmente na forma de minerais. Veja alguns exemplos:
Barita → sulfato de bário;
Gipsita → sulfato de cálcio;
Celestita → sulfato de estrôncio;
Anglesita → sulfato de chumbo;
Glauberita → sulfato duplo de cálcio e sódio: CaNa2(SO4)2;
Alúmen potássico (calinita) → sulfato de duplo de potássio e alumínio hidratado: KAl(SO4)2.11H2O
Entre os principais sulfatos existentes no cotidiano, temos o sulfato de cálcio, que na forma anidra (sem água) é usado na fabricação de giz escolar. Quando ele está na forma di-hidratada, (CaSO4 . 2H2O), ele é conhecido como gipsita e é mais abundante. Ao sofrer aquecimento, forma o sulfato de cálcio hemi-hidratado (CaSO4 . ½ H2O), que é o gesso, usado em ortopedia, moldes de odontologia, na construção civil e em tintas.

Outro sal importante é o sulfato de magnésio (MgSO4), conhecido como sal amargo ou sal de Epsom, que possui ação laxativa e é usado para massagens e banhos relaxantes.
Por Jennifer Fogaça
Graduada em Química
