Nitratos são um grupo de compostos que possuem em sua constituição o ânion nitrato, NO3-. Uma das grandes características dos nitratos é que todos são solúveis em água. São de grande importância para o ciclo do nitrogênio, sendo a principal fonte de nitrogênio para as plantas.
Nitratos também são utilizados como fertilizantes, herbicidas ou pesticidas. Porém, a utilização excessiva deles não é recomendada, pois podem contaminar a água e os lençóis freáticos. Também são utilizados na fabricação de explosivos, pólvora, fogos de artifício e até mesmo como conservantes de alimentos embutidos.
Leia também: Quais são as funções inorgânicas?
Tópicos deste artigo
- 1 - Resumo sobre nitratos
- 2 - O que são nitratos?
- 3 - Características dos nitratos
- 4 - Aplicações dos nitratos
- 5 - Precauções dos nitratos
- 6 - Exercícios resolvidos sobre nitratos
Resumo sobre nitratos
-
Os nitratos são compostos que possuem o ânion nitrato (NO3-) em sua constituição.
-
Todos os nitratos são solúveis.
-
Os nitratos são pouco reativos.
-
São utilizados na fabricação de fertilizantes, conservantes de alimentos e explosivos.
Não pare agora... Tem mais depois da publicidade ;) -
São vasodilatadores, sendo essenciais no combate ao câncer, diabetes, doenças cardíacas e disfunção erétil.
-
O consumo de nitratos a partir de alimentos ricos em proteínas, como carnes processadas, aumenta o risco de câncer de intestino por conta da formação das nitrosaminas.
O que são nitratos?
Os nitratos são compostos que possuem o ânion nitrato em sua composição (NO3-). Embora existam nitratos tanto inorgânicos quanto orgânicos, os inorgânicos são os que mais se destacam.
O nitrogênio presente apresenta NOx igual a +5 e esse ânion apresente geometria trigonal plana, conforme mostra a imagem a seguir, a qual representa a fórmula estrutural desse ânion.
De forma mais aprofundada, deve-se entender que os elétrons π do ânion nitrato não estão sempre na mesma ligação N-O, mas sim deslocalizados entre as três ligações N-O. Dessa forma, entende-se que o ânion nitrato apresenta o efeito de ressonância (igual ao benzeno e demais compostos aromáticos). Esse efeito é essencial para a estabilidade do ânion.
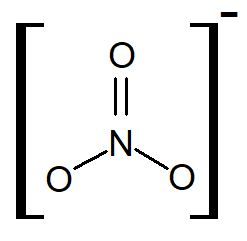
Por apresentar carga elétrica total negativa, os nitratos podem se ligar a cátions metálicos ou poliatômicos, como é o caso do cátion amônio, NH4+.
A produção de nitratos pode ocorrer por meio de algumas reações inorgânicas, como de adição ou ácido-base.
-
Produção do nitrato de amônio a partir da amônia gasosa (reação de adição):
NH3 (g) + HNO3 (aq) → NH4NO3 (aq)
-
Produção do nitrato de sódio a partir do hidróxido de sódio (reação ácido-base):
NaOH (aq) + HNO3 (aq) → NaNO3 (aq) + H2O (l)
O nome nitrato foi dado em razão de esse ânion ser produzido a partir do ácido nítrico e, pelas regras da Iupac, caso um ácido possua sufixo -ico, seu ânion possuirá sufixo -ato.
Veja também: Dióxido de enxofre — gás tóxico proveniente da queima de combustíveis fósseis e das indústrias
Características dos nitratos
A principal característica que temos dos nitratos é de que todos eles são solúveis. Em termodinâmica, sais formados por íons de carga baixa e tamanho grande são solúveis, como é o caso do nitrato. Não à toa os nitratos de prata (AgNO3) e amônio (NH4NO3) possuem uma solubilidade que ultrapassa os 200 g para cada 100 g de água na temperatura de 25 °C, afinal ambos são grandes e possuem uma carga pequena.
|
Nitrato |
Solubilidade em água a 25 °C (por 100 g de H2O) |
|
Sódio |
102,0 g |
|
Potássio |
91,2 g |
|
Cálcio |
38,3 g |
|
Amônio |
212,5 g |
|
Prata |
234,4 g |
|
Bário |
10,3 g |
Os nitratos também possuem uma boa estabilidade química, muito por causa do efeito de ressonância antes descrito. No ciclo do nitrogênio, por exemplo, as plantas não assimilam o nitrogênio na forma de nitrato, mas sim de amônio. Para isso, possuem um metabolismo capaz de reduzir o nitrato primeiramente ao íon nitrito, para então reduzir o nitrito ao íon amônio. Em nosso corpo, o nitrato também não participa de reações, sendo necessário que ela seja convertido a nitrito.
Aplicações dos nitratos
Os compostos de nitrogênio, como um todo, são utilizados na indústria de fertilizantes e, com os nitratos, não é diferente. Os nitratos são de suma importância para a produção da biomassa vegetal, ajudando a promover um crescimento mais rápido de produtos hortícolas, conferindo-lhes folhas mais vistosas e de maiores dimensões.
Ao serem assimilados pelas plantas na forma de amônio, os nitratos são convertidos em aminoácidos, iniciando no glutamato, precursor direto da prolina e da arginina, e, posteriormente, em outros tantos mais complexos.
Na indústria alimentícia, os nitratos, em especial o de sódio, são utilizados como conservantes de alimentos, impedindo a proliferação de bactérias nocivas no bacon, presunto, salame, queijos, salsichas e outros tipos de alimentos processados.
Na medicina, os nitratos são utilizados como vasodilatadores, sendo então o princípio ativo de medicamentos para o combate da angina, condição em que a redução do fluxo sanguíneo causa dor no peito. O suco de beterraba, por exemplo, tem alto teor de nitrato natural, que tem sido associado à redução da pressão arterial e ao aumento do rendimento esportivo. A conversão de nitratos em nitritos e, posteriormente, em óxido nítrico auxilia no combate a doenças cardíacas, diabetes e disfunção erétil.
Também se faz uso de nitratos, como o de amônio, na fabricação de explosivos. O nitrato de amônio em si não é explosivo, é estável, inclusive. Contudo, em um incêndio, como ocorreu na cidade de Beirute, no Líbano, no ano de 2020, a energia pode ser suficiente para decompor o nitrato de amônio, o qual produz gases que se expandem rapidamente e então explodem. O nitrato de amônio é também muito oxidante, o que incrementa a inflamabilidade de alguns compostos.

Além dos usos já descritos, como fertilizante e conservante alimentar, o nitrato de potássio vem sendo utilizado como propelente de foguetes, além da fabricação de diversos fogos de artifício. O nitrato de prata é fotossensível e, por isso, é também utilizado no preparo de filmes fotográficos.
Precauções dos nitratos
Os nitratos ingeridos por nós por meio de alimentos vegetais e processados podem ficar em nossa boca. Lá bactérias podem fazer sua redução a nitrito. Ao engolirmos os íons nitrito, seu contato com o ácido clorídrico do estômago pode produzir nitrosaminas, relacionadas ao câncer de intestino.
Contudo, isso só ocorre se houver uma fonte rica de aminas, a qual é encontrada em alimentos ricos em proteína. As nitrosaminas também podem ser formadas no cozimento em fogo alto, como no bacon frito. Por isso, deve-se evitar o alto consumo de nitratos oriundos de alimentos processados.
Contudo, deve-se lembrar que os nitratos oriundos de fontes vegetais são muito importantes no combate a doenças, como o próprio câncer, diabetes e doenças cardíacas.
Os nitratos também são os principais contaminantes de nitrogênio na água. Oriundos do excessivo uso de fertilizantes, os nitratos, altamente solúveis em água, atingem os cursos d’água por meio da lixiviação e pela contaminação dos lençóis freáticos.
Embora em adultos os efeitos não sejam tão nocivos, em crianças de até seis meses de idade é possível o desenvolvimento da “síndrome do bebê azul”, em que a criança fica azulada devido ao quadro de anaerobiose, provocada pela ineficiência do transporte de O2. Os nitratos, se convertidos em nitritos, conseguem oxidar o íon Fe2+ da hemoglobina para íon Fe3+, transformando-a em meta-hemoglobina, incapaz de transportar O2.
Veja também: Ácido clorídrico — hidrácido altamente corrosivo e tóxico
Exercícios resolvidos sobre nitratos
Questão 1 – (Enem 2016) Recentemente um estudo feito em campos de trigo mostrou que níveis elevados de dióxido de carbono na atmosfera prejudicam a absorção de nitrato pelas plantas. Consequentemente, a qualidade nutricional desses alimentos pode diminuir à medida que os níveis de dióxido de carbono na atmosfera atingirem as estimativas para as próximas décadas.
BLOOM, A.J. et. al. Nitrate assimilation is inhibited by elevated CO2 in field-grown wheat. Nature Climate Change, n.4, abr. 2014 (adaptado)
Nesse contexto, a qualidade nutricional do grão de trigo será modificada primeiramente pela redução de:
A) amido.
B) frutose.
C) lipídeos.
D) celulose.
E) proteínas.
Resolução
Alternativa E.
O nitrato absorvido pelas plantas é assimilado como íon amônio. Tal amônio é convertido em aminoácidos, sendo o primeiro a ser formado o glutamato. Posteriormente, longas e complexas reações metabólicas produzem os demais aminoácidos. Os aminoácidos são os monômeros das proteínas, ou seja, a ligação peptídica de diversos aminoácidos forma as proteínas. Por isso, a menor absorção de nitrato pelas plantas irá acarretar uma redução de proteínas, o que está descrito na letra E.
Questão 2 – (Uerj 2014) O nitrato, íon de geometria trigonal plana, serve como fonte de nitrogênio para as bactérias. Observe as seguintes fórmulas estruturais:
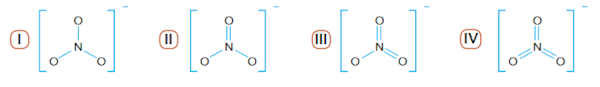
A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número:
A) I.
B) II.
C) III.
D) IV.
Resolução
Alternativa B.
Na montagem de fórmulas estruturais de íons poliatômicos, devemos seguir o seguinte procedimento:
1º) Contar o número total de elétrons de valência.
No caso, cada oxigênio tem 6 elétrons de valência, enquanto o nitrogênio tem 5, totalizando 23 elétrons de valência. Contudo, por ser o íon nitrato (NO3-), há um elétron a mais, totalizando 24 elétrons.
2º) Dispor pares de elétrons ligantes entre o átomo central e os demais átomos.
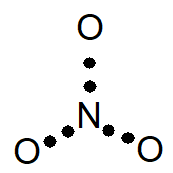
Dos 24, já foram colocados 6, sobrando 18.
3º) Completar o octeto dos átomos.
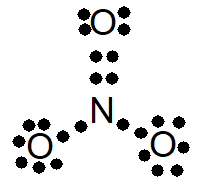
Repare que, agora, os 24 elétrons foram utilizados. Assim, a opção correta é a de letra B, que contém a estrutura II. Note que o elétron a mais é lembrado por uma representação fora do colchete.
Crédito da imagem
Por Stéfano Araújo Novais
Professor de Química

