A Teoria do Octeto estabelece que para que um átomo de um elemento químico fique estável, ele deve adquirir a configuração eletrônica de um gás nobre, isto é, deve possuir oito elétrons na camada de valência ou dois elétrons no caso de o átomo ter apenas a primeira camada eletrônica (K).
O berílio possui número atômico igual a 4. Portanto, seu átomo possui 4 elétrons e a sua distribuição eletrônica no estado fundamental é dada por:
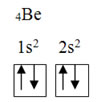
Configuração eletrônica do berílio
Isso significa que o berílio tem 2 elétrons na sua última camada, sendo da família 2A (metais alcalinoterrosos). Desse modo, ele possuiria a tendência de doar esses dois elétrons, ficando com a carga 2+, ou seja, teria a tendência de formar ligações iônicas.
No entanto, observa-se que os átomos do berílio realizam ligações covalentes, com compartilhamento de elétrons, como mostra o composto formado abaixo, o hidreto de berílio (BeH2):
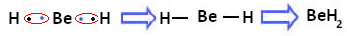
Formação de ligações covalentes do berílio com o hidrogênio
Observe que, nesse caso, o berílio fica estável com menos de oito elétrons em sua camada de valência, pois ao compartilhar os seus elétrons como os átomos de hidrogênio, ele passa a ter quatro elétrons em sua última camada. Trata-se, portanto, de uma exceção à regra do octeto.
Mas a ligação covalente geralmente ocorre porque o elemento possui orbitais incompletos. Por exemplo, como mostrado abaixo, o hidrogênio possui um orbital incompleto, por isso ele realiza apenas uma ligação covalente. O oxigênio possui dois orbitais incompletos e realiza duas ligações covalentes. O nitrogênio, por sua vez, possui três orbitais incompletos e, consequentemente, realiza três ligações covalentes:
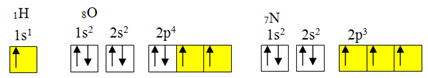
Distribuições eletrônicas do hidrogênio, oxigênio e nitrogênio
No entanto, como já mostrado, o berílio não possui orbitais incompletos.
Então, por que ele realiza ligações covalentes?
A explicação está na Teoria da hibridização, que diz que quando um elétron de um orbital recebe energia, ele “salta” para um orbital vazio mais externo, ficando no estado excitado e, desse modo, ocorre a fusão ou mistura dos orbitais atômicos incompletos, gerando orbitais híbridos que são equivalentes entre si e diferentes dos orbitais puros originais.
Por exemplo, no caso do berílio, um elétron do subnível 2s recebe energia e passa para um orbital do subnível 2p que estava vazio:
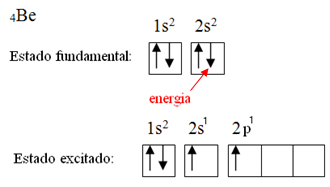
Estado excitado do berílio para a formação de orbitais híbridos
Desse modo, o berílio fica com dois orbitais incompletos, podendo realizar duas ligações covalentes.
Note que um orbital está em um subnível “s” e outro, no “p”, então, as ligações que o berílio realizaria deveriam ser diferentes. Porém, não é isso o que ocorre, porque com o fenômeno da hibridização, esses orbitais incompletos que se formaram irão se misturar, gerando dois orbitais denominados de híbridos ou hibridizados, que são iguais entre si. Além disso, visto que esses dois orbitais híbridos vieram de um orbital “s” e de um orbital “p”, dizemos que essa hibridização é do tipo sp:
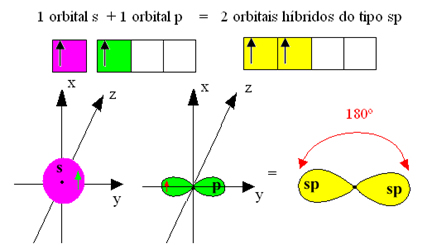
Formação de hibridização sp do berílio
Como os orbitais híbridos são iguais, as ligações covalentes que o berílio realiza com os átomos de hidrogênio também serão iguais:
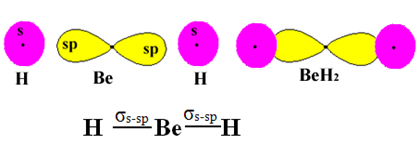
Interpenetrações dos orbitais híbridos do berílio com orbitais s dos hidrogênios
Observe que ele realiza, então, duas ligações sigma que são do tipo s-sp (σs-sp).
Por Jennifer Fogaça
Graduada em Química


