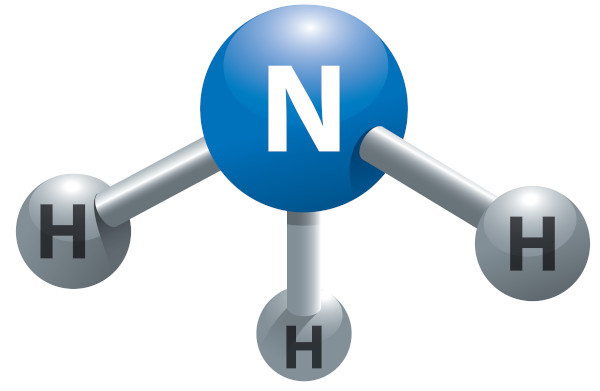
A amônia, de fórmula NH3, é um gás incolor, tóxico e de odor forte e desagradável. Apresenta geometria piramidal, além de ser o gás mais solúvel em água que se conhece, justamente pela formação de ligações de hidrogênio. É uma importante substância do ciclo global do nitrogênio.
É amplamente empregada como fertilizante, visto que o nitrogênio é um macronutriente para as plantas. Seu principal processo de produção é o processo Haber-Bosch, desenvolvido no começo do século XX. É uma substância que inspira cuidados, visto que tem grande potencial tóxico, e, em determinados casos, uma exposição a ela pode ser fatal.
Leia também: Amianto — substância que foi banida de diversos países pelos males à saúde
Tópicos deste artigo
- 1 - Resumo sobre a amônia
- 2 - Propriedades da amônia
- 3 - Quais são as características da amônia?
- 4 - Para que serve a amônia?
- 5 - Obtenção da amônia
- 6 - Precauções com a amônia
- 7 - História da amônia
Resumo sobre a amônia
- A amônia é uma molécula de fórmula NH3, polar, solúvel em água e de geometria piramidal.
- É um gás incolor, tóxico e de odor forte e desagradável.
- Boa parte da amônia produzida é destinada para a produção de fertilizantes, já que o nitrogênio é um macronutriente para as plantas.
- A principal forma de obtenção sintética da amônia se dá pelo processo Haber-Bosch, desenvolvido no começo do século XX.
- A amônia inspira cuidados, e a exposição a esse gás pode causar sérios problemas, inclusive a morte.
- Apesar de ser conhecida desde tempos antigos, só foi isolada e caracterizada no século XVIII.
Propriedades da amônia
- Fórmula molecular: NH3.
- Massa molar: 17,031 g.mol-1.
- Ponto de fusão: -77,73 °C.
- Ponto de ebulição: -33,33 °C.
- Densidade: 0,696 g.L-1.
- Aparência física: gás incolor.
- Solubilidade: muito solúvel em água (≈ 530 g.L-1 a 20 °C); solúvel em etanol e éter etílico.
- Momento dipolar: 1,47 D (molécula polar).
- Geometria molecular: piramidal.
Quais são as características da amônia?
A amônia é um gás incolor, tóxico e de odor pungente. Ocorre na natureza, principalmente pelo decaimento anaeróbico de matéria vegetal e animal, sendo também detectada no espaço sideral. Alguns legumes, combinados com as bactérias Rhizobium, são capazes de fixar o nitrogênio atmosférico e assim produzir NH3, em uma importante etapa do ciclo global do nitrogênio.
Quando reage com o oxigênio, em uma combustão, produz o gás nitrogênio e água:
4 NH3 + 3 O2 → 2 N2 + 6 H2O
Entre os gases, a amônia é a que possui a maior solubilidade em água, consequência direta da formação da ligação de hidrogênio dela com as moléculas de H2O. Possui também caráter levemente básico, por conta da seguinte reação de ionização:
NH3 (aq) + H2O (l) ⇌ NH4+ (aq) + OH- (aq) Kb = 1,8 x 10-5
O baixo valor de Kb mostra que pouca amônia se ioniza, e, por isso, mesmo em soluções diluídas, o cheiro de amônia ainda é perceptível.
Para que serve a amônia?
Mais de 80% da produção mundial de amônia é usada diretamente ou não na agricultura. Entre os fertilizantes que são produzidos por meio da amônia estão a ureia, o fosfato de amônio, o nitrato de amônio, além de outros nitratos. Segundo o Serviço Geológico dos Estados Unidos (US Geological Survey), em 2018 a produção mundial de amônia foi de cerca de 144 milhões de toneladas, sendo a Ásia a principal produtora, muito por conta da China.
Isso tudo porque o nitrogênio é um dos macronutrientes das plantas e, por isso, trata-se de um elemento essencial para o seu bom crescimento.

A amônia também tem importância na síntese do ácido nítrico, uma das substâncias químicas mais produzidas e comercializadas do mundo. O processo se inicia com a oxidação do NH3 a NO, por meio da combustão da amônia em temperatura de 1200 K na presença de um catalisador de ródio e platina (Rh/Pt):
4 NH3 + 5 O2 → 4 NO + 6 H2O
O NO é então misturado com ar e absorvido em contracorrente de água, produzindo, após algumas etapas, o ácido nítrico, com uma concentração de cerca de 60% em massa.
Entre usos minoritários, está a aplicação da amônia na indústria de cosméticos e também na composição de produtos de limpeza e alvejantes.
Leia também: Nitrato de amônio — composto altamente reativo usado em fertilizantes e em explosivos
Obtenção da amônia
A principal forma de produção de amônia se dá pelo processo Haber-Bosch, desenvolvido inicialmente em 1908 pelo químico alemão Fritz Haber e então adaptado para escala industrial pelo químico e engenheiro alemão Carl Bosch entre 1909 e 1913. Ambos foram laureados com o Prêmio Nobel de Química pelo feito.

A reação do processo é a que se segue:
N2 + 3 H2 ⇌ 2 NH3
O hidrogênio é produzido por meio do metano, CH4, com vapor e ar, produzindo CO e o gás hidrogênio. O próprio CO pode também reagir com o vapor para produzir mais gás hidrogênio.
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
O desafio do processo Haber-Bosch é o rendimento e, para que um bom rendimento seja alcançado, as condições termodinâmicas devem ser muito bem ajustadas, em uma aplicação clássica dos princípios de Físico-Química em sistemas em equilíbrio.
Sendo uma reação exotérmica (ΔH = - 92 kJ.mol-1), o aumento de temperatura, apesar de aumentar a velocidade da reação química, diminui o rendimento da reação. Em uma dada temperatura, tanto a velocidade da reação quanto seu rendimento são majorados em uma situação de pressão elevada. A presença de um catalisador também facilita o processo. Assim sendo, as condições ideais de produção são com a temperatura próxima de 450 °C, uma pressão de 20.260 kPa e um catalisador heterogênio de Fe3O4 misturado com K2O, SiO2 e Al2O3.
Precauções com a amônia
A amônia é um gás tóxico, contudo as concentrações naturais desse composto não são perigosas para nós. Já para aqueles que trabalham com essa substância, a atenção deve ser constante, visto que em níveis maiores de exposição o NH3 pode causar danos sérios, tais como irritações na pele, nos olhos, na garganta e nos pulmões, além da ocorrência de tosses e queimaduras. Quando a concentração de amônia está na faixa de 2500 a 4000 ppm (mg.L-1) no ar, ela causa a morte de um ser humano em cerca de 30 minutos e em níveis maiores de concentração, como de 5000 a 10000 ppm, a morte é praticamente instantânea.
Apesar disso tudo, a amônia não é classificada como uma substância cancerígena pela Agência Internacional de Pesquisa em Câncer (IARC).
História da amônia
Embora se entenda que a amônia já seja conhecida desde tempos remotos, uma das primeiras referências a uma solução aquosa dessa substância vem do trabalho de Raymond Lully, um missionário catalão que viveu entre os séculos XIII e XIV. O livro O Químico Cético (do inglês The Sceptical Chymist), do ano de 1661 e de autoria de Robert Boyle, também menciona uma solução aquosa de amônia, da mesma forma que Johann Kunkel van Lowenstern menciona o gás em seus trabalhos.
A descoberta é creditada ao inglês Joseph Pristly*, que isolou e caracterizou o composto no ano de 1773 ao aquecer uma solução aquosa de amônia (chamada por ele de “espírito volátil do sal amoníaco”). À época, Pristly referiu-se ao gás como “ar alcalino”. Em 1782, o químico sueco Torburn Olof Bergman sugeriu o nome de amônia para o “ar alcalino” e, em 1785, o químico francês Claude Louis Berthollet determinou a composição química da amônia.
* A American Chemical Society também credita o sueco Joseph Black, o irlandês Peter Woulfe e o sueco Carl Wilhelm Scheele como cientistas que isolaram a amônia.
Por Stéfano Araújo Novais
Professor de Química

