Os cloretos são aqueles compostos iônicos que contêm o ânion Cℓ-1.
O cloro é da família 17 ou 7A, seu número atômico é igual a 17 e possui 7 elétrons na camada de valência (camada eletrônica mais externa do átomo). Segundo a regra do octeto, para ficar estável, ele precisa ter 8 elétrons nessa última camada e, portanto, precisa receber mais um elétron. Quando isso acontece, isto é, quando ele recebe um elétron, em geral, de uma ligação iônica com um metal, forma-se o ânion cloreto (Cℓ-1), o metal que cedeu o elétron torna-se um cátion e a substância formada é iônica.
Os cloretos são sais derivados da reação de uma base com o ácido clorídrico (HCℓ(aq)). A base fornece o cátion e o ácido clorídrico fornece o íon cloreto:
Base genérica + Ácido clorídrico → Cloreto + Água
COH + HCℓ → CCℓ + H2O
Os cloretos são todos classificados como sais inorgânicos, pois em meio aquoso liberam um cátion diferente de H+ e liberam o ânion cloreto, e não a hidroxila (OH-).
A nomenclatura dos cloretos sempre segue essa regra: Cloreto + de + (nome do elemento ligado ao cloro). As suas fórmulas são formadas trocando-se as cargas dos íons pelos índices (número que fica na parte inferior à direita do símbolo do elemento, indicando a quantidade de átomos de tal elemento que está presente realizando ligações).
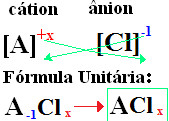
Se o índice for “1”, não é preciso escrevê-lo na fórmula, como mostrado abaixo:
Na+1 Cℓ-1 → Na1Cℓ1 → NaCℓ: cloreto de sódio;
K+1 Cℓ-1 → KCℓ: cloreto de potássio;
Ca+2 Cℓ-1 →CaCℓ2: cloreto de cálcio;
Ba+2 Cℓ-1 →BaCℓ2: cloreto de bário;
Aℓ+3 Cℓ-1 →AℓCℓ3: cloreto de alumínio.
No entanto, conforme explicado no texto “Substâncias iônicas do grupo: cloreto, carbonato, nitrato e sulfato”, assim como ocorre com toda substância iônica, os cloretos não possuem as suas fórmulas unitárias isoladas na natureza, pois os seus íons atraem-se mutualmente e formam os retículos cristalinos.
O principal exemplo de cloreto que temos em nosso cotidiano é o cloreto de sódio, NaCℓ, o sal de cozinha. Veja a ligação iônica que resulta na sua formação (em que o sódio doa um elétron para o cloro) e mais abaixo o retículo cristalino desse sal:
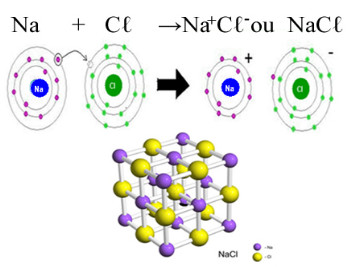
No retículo cristalino do cloreto de sódio cada ânion Cℓ- está circundado por 6 cátions Na+ e vice-versa, portanto o número de coordenação desse retículo cristalino é 6.
Todos os cloretos são sólidos em condições ambientes e bastante solúveis em água, estando entre os sais mais comuns encontrados em nosso cotidiano, tendo em vista que vários deles estão presentes dissolvidos nas águas minerais, potáveis, de torneira, de rios, de mares, entre outras. Entre as exceções, sendo cloretos insolúveis em água, estão o cloreto de prata (AgCℓ - mostrado na figura a seguir), de chumbo, compostos de cobre e mercúrio.

Cloreto de prata insolúvel em água*
Os íons Cℓ-1 provenientes dos cloretos que ingerimos, principalmente no sal, peixes e carnes, são importantes para algumas funções do organismo humano, pois são o principal ânion extracelular, estão presentes no suco gástrico, regulam fluidos corpóreos, como distribuição de água no organismo, e mantêm a pressão osmótica do plasma e a neutralidade elétrica.
Sua carência pode provocar ansiedade, diarreia e problemas circulatórios. O seu excesso é excretado pela urina (em média, cada pessoa excreta cerca de 4 g de cloreto por dia), suor e fezes.
* Crédito da imagem: Autor: Danny S. / Imagem extraída de: Wikimedia Commons
Por Jennifer Fogaça
Graduada em Química
