Grau de ionização, representado pela letra α (alfa), se define como a relação entre o número de moléculas ionizadas e o número total de moléculas dissolvidas. Equação para cálculo:
![]()
Vamos a um exemplo prático:
Se dissolvermos ácido clorídrico (HCl) em água, qual a quantidade de moléculas que sofreria ionização?
O HCl em água sofre ionização, liberando íons H+ e Cl-.
HCl → H+ + Cl-
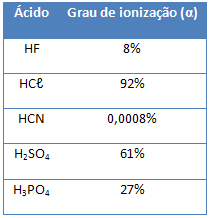
Se avaliarmos 100 moléculas de HCl em meio aquoso, temos que apenas 92 sofrem ionização, ou seja, o Grau de ionização é de 92 %.
É com base nesse grau de ionização que podemos classificar um ácido em forte, moderado ou fraco, veja a tabela:

Assim temos que:
• Ácido forte: aquele que se ioniza em 50%.
• Ácido moderado (ou semiforte): grau de ionização maior que 5% e menor que 50%.
• Ácido fraco: a ionização ocorre em apenas 5% de sua molécula.
A classificação para o HCl, de acordo com a tabela, é de ácido forte.
Vamos a um exemplo de ácido moderado. O ácido fluorídrico (HF) se ioniza conforme a equação:
HF → H+ + F-
Esse ácido se classifica como semiforte porque tem menos de 50% de suas moléculas ionizadas.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!
Ácidos mais comuns na química do cotidiano
Nomenclatura dos ácidos