Dióxido de carbono (CO2) é um gás incolor e inodoro muito conhecido como gás carbônico. É uma molécula de geometria linear, cujas formas sólidas podem ser obtidas por grande elevação da pressão e redução da temperatura. Dentre elas, a mais conhecida é a do gelo seco. O CO2 é considerado a principal fonte ácida do meio ambiente, sendo essencial para a formação de corais e minerais carbonatados.
O dióxido de carbono é utilizado como gás refrigerante, na produção de bebidas carbonatadas e na produção da ureia, principalmente. É um participante do ciclo do carbono e um importante regulador da temperatura do nosso planeta. Contudo, seus altos níveis na atmosfera, elevados por conta da atividade humana em decorrência da utilização de combustíveis fósseis, têm causado o chamado “aquecimento global antropogênico”, o que traz consequências severas para o meio ambiente e o clima.
Leia também: Afinal, o que é o carbono (C)?
Tópicos deste artigo
- 1 - Resumo sobre o dióxido de carbono
- 2 - O que é dióxido de carbono?
- 3 - Características do dióxido de carbono
- 4 - Propriedades do dióxido de carbono
- 5 - Aplicações do dióxido de carbono
- 6 - Obtenção e ocorrência do dióxido de carbono
- 7 - Importância do dióxido de carbono
- 8 - Riscos e impactos do dióxido de carbono
Resumo sobre o dióxido de carbono
-
O dióxido de carbono (CO2) é um óxido ácido, também chamado de gás carbônico.
-
Apresenta-se como um gás incolor e inodoro, com geometria linear.
-
Suas formas sólidas podem ser obtidas por grande elevação de pressão e diminuição brusca da temperatura, como é o caso do gelo seco.
-
O dióxido de carbono é a principal fonte ácida do meio ambiente, sendo essencial para a formação de corais.
Não pare agora... Tem mais depois da publicidade ;) -
O CO2 pode ser usado como agente refrigerante, na produção de bebidas carbonatadas, na produção da ureia, entre outros usos.
-
É participante do ciclo do carbono, sendo obtido em processos como a respiração anaeróbica e aeróbica e na combustão de combustíveis fósseis.
-
É um gás estufa, e seu excesso na atmosfera tem causado o chamado “aquecimento global antropogênico”, com consequências para o clima e meio ambiente.
O que é dióxido de carbono?
De fórmula molecular CO2, o dióxido de carbono é um óxido de caráter ácido, também conhecido como gás carbônico.
Características do dióxido de carbono
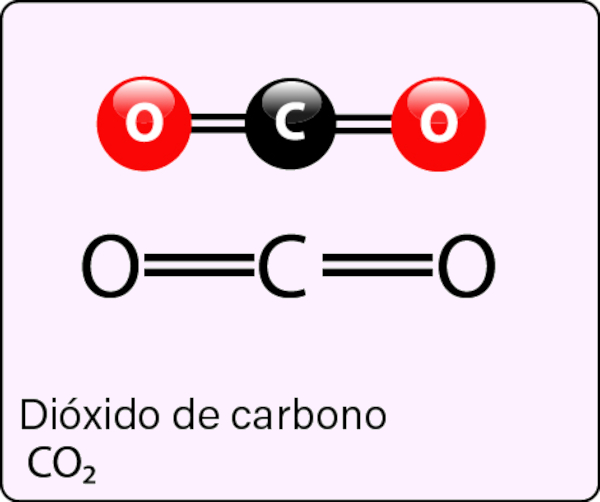
O dióxido de carbono (CO2) ocorre naturalmente na forma de um gás incolor e inodoro. Sua molécula possui geometria linear e consiste em um carbono centralizado ligado por meio de ligações covalentes duplas aos dois átomos de oxigênio (O=C=O). Quimicamente, o CO2 é classificado como um óxido ácido.
As formas sólidas do CO2 podem ser obtidas em baixa temperatura e alta pressão, sendo o gelo seco o maior exemplo. Para essa forma, o gás é liquefeito em uma pressão de 6 MPa e, posteriormente, resfriado (ainda sob essa pressão) ao seu ponto de congelamento (-79 °C). Contudo, em pressão atmosférica ambiente o gelo seco rapidamente sublima (passagem direta do estado sólido para o estado gasoso).
Os níveis de dióxido de carbono na atmosfera têm crescido dada a grande utilização de combustíveis fósseis. Segundo a Nasa, em março de 2024, os níveis de CO2 na atmosfera eram equivalentes a 425 ppm (parte por milhão, mg.kg−1).
Propriedades do dióxido de carbono
-
Fórmula molecular: CO2.
-
Massa molecular: 44,010 u.
-
Densidade: 1,799 g.L−1.
-
Ponto de fusão: −56,6 °C (no ponto triplo, 5,2 atm de pressão).
-
Ponto de ebulição: −78,6 °C (em pressão ambiente, sublima).
Não pare agora... Tem mais depois da publicidade ;)
O dióxido de carbono é a principal fonte ácida do meio ambiente, e, além disso, sua baixa solubilidade em água apresenta grande importância bioquímica e geoquímica. Isso acontece porque, quando dissolvido em água, forma um equilíbrio com sua espécie ácida, o H2CO3.
CO2 (aq) + H2O (l) ⇌ H2CO3 (aq)
Nesse equilíbrio, boa parte do soluto está na forma de CO2 e não como H2CO3 (K ≈ 1,7 x 10−3). Mesmo assim, o H2CO3 é desprotonado a bicarbonato (HCO3−) e carbonato (CO32−), justificando a leve acidez da solução e, também, o porquê de os carbonatos serem os minerais mais abundantes do planeta, uma vez que essas espécies podem reagir com cátions presentes, como o cálcio e magnésio, assim formando rochas carbonatadas.
H2CO3 + 2 H2O ⇌ HCO3− + H3O+ + H2O ⇌ CO32− + 2 H3O+
Veja também: O que é o monóxido de carbono (CO)?
Aplicações do dióxido de carbono

O dióxido de carbono é muito usado como agente refrigerante, principalmente por conta da formação do gelo seco. Nessa forma, pequenos pedaços de CO2 podem ser adicionados em solventes, como o dietilenoglicol, o etanol, a acetona, o éter dietílico e a acetonitrila, para criar banhos a frio, cujas temperaturas variam de -20 °C a -100 °C. Mas não só para fins refrigerantes é usado o gelo seco, pois ele é muito empregado para criação de fumaça em shows, festas e outros eventos culturais.
O CO2 é empregado na forma de um fluido supercrítico, que é um estado que a matéria atinge, no estado gasoso, em que não mais pode retornar ao estado líquido, não importando quão alta será a pressão exercida. No ponto crítico, o menisco que existe entre a fase líquida e gasosa deixa de existir, não havendo mais distinção entre esses estados. A vantagem é que o fluido supercrítico carrega comportamentos de um líquido, ou seja, capaz de dissolver solutos, por exemplo, mas também comportamentos de um gás, como a capacidade de se misturar com outros gases presentes homogeneamente e penetrar nos poros dos sólidos presentes.

O gás carbônico é usado na indústria alimentícia, na produção de bebidas carbonatadas, como água com gás e refrigerantes. Na agricultura, pode ser usado na confecção de fertilizantes, assim como pode ser bombeado em armazéns e silos para matar insetos e proteger os produtos. Na indústria química, pode ser usado para a síntese da ureia (reação de Bazarov, representada a seguir) e do metanol.
CO2 + 2 NH3 → NH2COONH4
NH2COONH4 → NH2CONH2 + H2O

O CO2 pode ser usado no campo da saúde como um estimulante respiratório, bem como funcionar como um anestésico. Outro importante uso é na fabricação de extintores de incêndio, indicado para combater incêndios de classe B (líquidos inflamáveis) e C (equipamentos eletrônicos).
Obtenção e ocorrência do dióxido de carbono

O dióxido de carbono está dentro do ciclo do carbono, circulando pelo ar atmosférico e águas superficiais, na fotossíntese, respirações aeróbia e anaeróbia, decomposição e, obviamente, na formação, a partir da combustão completa, de combustíveis fósseis, tais como carvão mineral, gás natural (metano) e petróleo.
Na combustão, as fontes de carbono devem reagir com excesso de oxigênio, caso contrário podem formar o monóxido de carbono, CO. Um exemplo é a combustão do gás metano, CH4.
CH4 + 2 O2 → CO2 + 2 H2O
Importância do dióxido de carbono
O CO2 possui vantagens para o nosso planeta. No que diz respeito à Terra, tal composto tem um importante papel na regulação da temperatura de nosso planeta, sendo um reconhecido “gás de efeito estufa”. O Sol envia para a Terra energia na forma de radiação eletromagnética, a qual é refletida e repelida na superfície do nosso planeta. Tal energia é enviada novamente para o espaço, mas na forma de radiação infravermelha. O CO2, entretanto, tem grande capacidade de absorção da radiação infravermelha, impedindo que se disperse no espaço. Assim, ela é reemitida para o nosso planeta, fazendo com que a superfície se aqueça.
A ausência do CO2, segundo especialistas, faria com que a temperatura média da superfície da Terra fosse significativamente menor, sendo na faixa dos -18 °C, inviabilizando, em boa parte ou totalmente, a ocorrência de água no estado líquido.
Acesse também: O que são os gases do efeito estufa (GEE)?
Riscos e impactos do dióxido de carbono
Com a massiva utilização de combustíveis fósseis e com a decomposição do calcário (CaCO3) para a produção de cimento, a atividade humana tem aumentado bastante a concentração de CO2 na atmosfera, causando um efeito conhecido como “aquecimento global antropogênico”.
Dados disponibilizados pela Nasa indicam que a atividade humana aumentou a concentração desse composto na atmosfera em 50% em menos de 200 anos (desde o início da Primeira Revolução Industrial). Por exemplo, a quantidade de CO2 na atmosfera em 1960 era na faixa dos 317 ppm, enquanto atualmente está na faixa dos 425 ppm. A Nasa ainda demonstra, a partir de leituras de CO2 coletadas em bolhas de ar presentes em camadas de gelo, que os níveis atuais superam todos os picos dessa substância nas últimas três eras glaciais.
Assim, o que se percebe são aumentos acima do normal da temperatura média da superfície do nosso planeta. Os dados compilados pela Nasa demonstram que a Terra está cerca de 1,36 °C mais quente comparando-se com o final do século XIX, e, para piorar, os últimos dez anos são os mais quentes já registrados. Outro efeito nocivo do aquecimento global é a elevação de temperatura dos oceanos. Quanto mais quentes estiverem os oceanos, maiores as taxas de evaporação, ocasionando chuvas mais volumosas e, por conseguinte, mais catastróficas.
Além disso, a maior produção de CO2 aumenta a sua concentração nos oceanos, acidificando-os e pondo em risco a integridade de corais. Isso se dá porque a maior quantidade de CO2 diminui a quantidade de carbonato, essencial para a formação de corais. As reações a seguir explicam o porquê:
-
O CO2 reage com a água, formando ácido carbônico.
CO2 (aq) + H2O (l) ⇌ H2CO3 (aq)
-
O carbonato de cálcio, formador do exoesqueleto dos corais, apresenta uma pequena solubilidade em água, dissociando-se em íons cálcio e carbonato.
Não pare agora... Tem mais depois da publicidade ;)
CaCO3 (s) ⇌ Ca2+ (aq) + CO32− (aq)
-
O ácido carbônico se dissocia em íons H+ e bicarbonato (HCO3−).
H2CO3 (aq) ⇌ H+ (aq) + HCO3− (aq)
-
Os íons H+ reagem com o carbonato, fazendo com que sua concentração no meio diminua, forçando que o equilíbrio de solubilidade do CaCO3 forneça mais íons carbonato.
H+ (aq) + CO32− (aq) ⇌ HCO3− (aq)
-
Dessa forma, os íons carbonato são consumidos e os íons cálcio não possuem a contraparte para a formação do CaCO3.
Não pare agora... Tem mais depois da publicidade ;)
A reação simplificada do processo descrito é a que se segue:
CO2 (aq) + H2O (l) + CaCO3 (s) → Ca2+ (aq) + 2 HCO3− (aq)

E por mais que determinados países sejam mais conscientes quanto à produção de CO2 na atmosfera, deve-se relembrar que ele é transportado por longas distâncias no planeta, por ação de correntes de vento e marítimas, poluindo regiões distantes do seu ponto de produção. O aquecimento global antropogênico tem grande influência no clima, tornando mais frequentes chuvas de grande porte, furacões, além de ondas de calor e aumento dos níveis do oceano, muito por conta do derretimento das calotas polares.
Fontes
ADAMCZYK, K.; PRÉMONT-SCHWARZ, M.; PINES, D.; PINES, E.; NIBBERING, E. T. J. Real-Time Observation of Carbonic Acid Formation in Aqueous Solution. Science, v. 326, n. 5960, p. 1690-1694, dez. 2009.
ATLAS COPCO. What are commercial and industrial uses of carbon dioxide? Disponível em: https://www.atlascopco.com/en-us/compressors/wiki/compressed-air-articles/carbon-dioxide-uses.
ESCOBAR, H. Aquecimento global pode aniquilar recifes de coral no Brasil e no mundo. Jornal da USP, 27 ago. 2021. Disponível em: https://jornal.usp.br/ciencias/aquecimento-global-pode-aniquilar-recifes-de-coral-no-brasil-e-no-mundo/.
GOEL, S.; AGARWAL, D. Carbon Dioxide. Encyclopedia of Toxicology, 3a. ed. p. 675-677. Cambridge, EUA: Academic Press, 2014.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 2. ed. Pearson Education Limited: Londres, 2005.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
HAMMERL, A.; KLAPÖTKE, T. M. Nitrogen: Inorganic Chemistry. In: Encyclopedia of Inorganic Chemistry. 2. ed. Wiley: Nova Jersey, 2005.
LUDWIG, R.; KORNATH, A. In Spite of the Chemist’s Belief: Carbonic Acid Is Surprisingly Stable. Angewandte Chemie International Edition, v. 39, n. 8, 2000.
NATIONAL AERONAUTICS AND SPACE ADMINISTRATION – NASA. Carbon Dioxide. Disponível em: https://climate.nasa.gov/vital-signs/carbon-dioxide/?intent=121.

