Soluções são misturas homogêneas, ou seja, sistemas em que os componentes apresentam alto grau dispersão, de forma que as propriedades físico-químicas são as mesmas em toda a sua extensão. Toda solução é formada por um soluto (disperso) e um solvente (dispersante). As soluções podem ser sólidas, líquidas ou gasosas.
Soluções apresentam um parâmetro importante conhecido como coeficiente de solubilidade — a quantidade de soluto que é capaz de ser dissolvida em uma quantidade padrão de solvente, em dada temperatura. As soluções podem ser classificadas entre soluções insaturadas, saturadas ou supersaturadas, com base na avaliação do coeficiente de solubilidade. Soluções podem sofrer ainda operações, como diluições e misturas entre si.
Leia também: Substâncias puras x misturas — qual a diferença?
Tópicos deste artigo
- 1 - Resumo sobre soluções
- 2 - Videoaula sobre soluções
- 3 - O que são soluções?
- 4 - Quais são os tipos de soluções?
- 5 - Coeficiente de solubilidade
- 6 - Classificação das soluções
- 7 - Concentração das soluções
- 8 - Diluição das soluções
- 9 - Mistura das soluções
- 10 - Exercícios resolvidos sobre soluções
Resumo sobre soluções
- Soluções são misturas homogêneas, as quais podem ser sólidas, líquidas ou gasosas.
- Nas soluções, o alto grau de dispersão dos componentes permite afirmar que as propriedades físico-químicas são iguais em toda sua extensão.
- As soluções são formadas por soluto (material disperso) e solvente (material dispersante).
- O coeficiente de solubilidade indica a quantidade máxima de soluto que pode ser dissolvido em uma quantidade padrão de solvente em dada temperatura.
- Uma solução, com base em seu coeficiente de solubilidade, pode ser classificada como saturada, insaturada ou supersaturada.
- Para uma solução, pode-se calcular sua concentração, trazendo uma avaliação quantitativa de quanto soluto está disperso.
- Soluções podem sofrer operações, como a diluição e as misturas.
Videoaula sobre soluções
O que são soluções?
Soluções são misturas homogêneas, ou seja, sistemas em que as moléculas ou os íons componentes estão tão bem dispersos que a composição química e as propriedades físico-químicas são as mesmas em toda sua extensão, independentemente do seu tamanho. Toda solução possui uma substância dominante, conhecida como solvente, que atuará como dispersante. Já as demais substâncias, as quais estão dispersas, são chamadas de solutos. Assim sendo, os solutos são dissolvidos pelo solvente.
Quais são os tipos de soluções?
As soluções podem ser classificadas, de acordo com o estado físico do solvente, em:
- Sólidas: o solvente é um sólido, como é o caso do bronze, latão, dos amálgamas e de diversas outras ligas metálicas.
- Líquidas: o solvente é um líquido, como é o caso da água mineral, do soro fisiológico e da gasolina comercial.
- Gasosas: o solvente é um gás, como é o caso do ar atmosférico, cujo componente dominante é o gás nitrogênio, seguido pelo gás oxigênio e então outros gases em concentração minoritária.

Vale destacar que toda mistura gasosa é, obrigatoriamente, homogênea, sendo assim uma solução, considerando que os gases se difundem e se misturam por completo, sempre tomando a forma e o volume do recipiente em que estão inseridos. Alguns autores não configuram as misturas gasosas como soluções, mesmo sendo possível indicar uma substância dominante nelas.
Veja também: Quais os principais métodos de separação de misturas?
Coeficiente de solubilidade
A solubilidade é função da temperatura. No caso da solubilidade de gases em líquidos, quanto menor a temperatura, maior a solubilidade. Isso porque a menor energia cinética dificulta o desprendimento do gás do seio do líquido. Os solutos gasosos também têm sua solubilidade ligada à pressão, conforme é previsto pela lei de Henry. Tal lei determina que a solubilidade de um gás em um líquido, em temperatura constante, é diretamente proporcional à sua pressão parcial acima do líquido.
No caso das demais soluções, a influência da temperatura é meramente experimental. Portanto, nesse ponto, foi cunhado o coeficiente de solubilidade, que significa a máxima quantidade de soluto que uma quantidade padrão de solvente é capaz de dissolver em dada temperatura.
Na maioria das vezes, o solvente utilizado é a água, sendo que a quantidade padrão pode ser dada em gramas, ou mililitros, aproveitando-se de a densidade da água ser aproximadamente igual a 1 g/mL em toda sua faixa líquida.
A tabela a seguir traz os coeficientes de solubilidade de alguns compostos inorgânicos em água durante seu intervalo líquido (0 °C a 100 °C). Os dados estão em percentual mássico de soluto (100 ∙ w2):
\(w_2=\frac{m_2}{m_1+m_2}\)
Em que m2 é a massa do soluto e m1 é a massa do solvente. A conversão para massa de soluto, em gramas, para cada 100 gramas de H2O, pode ser feita por meio da seguinte expressão:
\(\text{massa do soluto para cada 100 gramas de água}=\frac{100\cdot w_2}{(1-w_2)}\)
|
Composto |
BaCl2 |
Ca(NO3)2 |
KBr |
NaCl |
Li2CO3 |
|
0 °C |
23,30 |
50,1 |
35,0 |
26,28 |
1,54 |
|
10 °C |
24,88 |
53,1 |
37,3 |
26,32 |
1,43 |
|
20 °C |
26,33 |
56,7 |
39,4 |
26,41 |
1,33 |
|
25 °C |
27,03 |
59,0 |
40,4 |
26,45 |
1,28 |
|
30 °C |
27,70 |
60,9 |
41,4 |
26,52 |
1,24 |
|
40 °C |
29,00 |
65,4 |
43,2 |
26,67 |
1,15 |
|
50 °C |
30,27 |
77,8 |
44,8 |
26,84 |
1,07 |
|
60 °C |
31,53 |
78,1 |
46,2 |
27,03 |
0,99 |
|
70 °C |
32,81 |
78,2 |
47,6 |
27,25 |
0,92 |
|
80 °C |
34,14 |
78,3 |
48,8 |
27,50 |
0,85 |
|
90 °C |
35,54 |
78,4 |
49,8 |
27,78 |
0,78 |
|
100 °C |
37,05 |
78,5 |
50,8 |
28,05 |
0,72 |
Embora a maioria dos compostos aumente sua solubilidade com o aumento da temperatura, alguns sais, como o Li2CO3, diminuem sua solubilidade com o aumento da temperatura. Além disso, o impacto da temperatura na solubilidade também é variável.
No gráfico anterior, vê-se que compostos como BaCl2, Ca(NO3)2 e KBr mudam de forma significativa sua solubilidade com a temperatura, enquanto o NaCl mantém a solubilidade praticamente constante durante a faixa líquida da água.
Classificação das soluções
Uma das formas de se classificar as soluções é de acordo com o coeficiente de solubilidade.
→ Solução insaturada
É a classificação para soluções cuja quantidade de soluto dissolvido é menor que a estabelecida pelo coeficiente de solubilidade para aquela temperatura.
Por exemplo, no gráfico do tópico anterior vimos que, na temperatura de 30 °C, 100 gramas de água são capazes de dissolver 38,3 gramas de BaCl2. Isso quer dizer que: qualquer quantidade de BaCl2 que, proporcionalmente, for menor que 38,3 g BaCl2/100 g H2O na temperatura de 30 °C, então a solução será considerada insaturada.
→ Solução saturada
É a classificação para soluções cuja quantidade de soluto dissolvido é igual à quantidade estabelecida pelo coeficiente de solubilidade para aquela temperatura.
Um ponto interessante é que, na prática, para se confirmar a saturação de uma solução líquida, adiciona-se uma massa adicional de soluto. Caso a solução esteja saturada de fato, o soluto não é passível de dissolução e a massa sólida não dissolvida acaba por se acumular no fundo, recebendo o nome de precipitado ou corpo de fundo.

→ Solução supersaturada
É a classificação para soluções cuja quantidade de soluto dissolvido excede a quantidade estabelecida pelo coeficiente de solubilidade para aquela temperatura. Na prática, soluções supersaturadas são instáveis. Para que possam ser formadas, devemos alterar a temperatura até um ponto em que uma maior massa de soluto possa ser dissolvida e, então, deixamos a temperatura variar, lentamente, para a temperatura de partida.
Nesse caso, o soluto, apesar da mudança da temperatura, permanece dissolvido. Porém, qualquer perturbação no sistema faz com que o soluto saia do seio da solução e se precipite, no caso de sólidos, ou saia na forma de uma espuma ou algo semelhante, no caso de gases.
É o caso de cervejas, em que a concentração de gás carbônico está além do permitido para as condições de consumo. A partir do momento que a garrafa é aberta e o líquido é vertido no copo, o sistema é perturbado e o gás carbônico sai do seio da solução na forma de uma espuma branca.
Concentração das soluções
A concentração serve para expressar a quantidade de soluto presente em uma quantidade de solvente. Graças às medidas de concentração, podemos ter uma maior noção se a solução está diluída ou concentrada. A União Internacional de Química Pura e Aplicada (Iupac) cita que uma solução pode ser considerada diluída quando a soma das frações molares dos solutos for pequena se comparada ao valor 1, o valor máximo do somatório de todas as frações molares presentes na solução.
Contudo, no dia a dia, usamos o conceito de solução diluída ou concentrada quando comparamos soluções distintas, ou seja, uma solução pode ser mais diluída em relação à outra solução, porém essa mesma solução pode ser mais concentrada em relação à outra solução. A determinação das concentrações pode ser realizada por meio de diversas expressões matemáticas, cujas fórmulas são apresentadas a seguir.
- Concentração comum (C): determina a massa de soluto presente em dado volume de solução. Em geral, utiliza-se a unidade de massa em gramas e a unidade de volume em litros.
\(C=\frac{\text{massa do soluto}(g)}{\text{volume da solução}(L)}\)
- Concentração molar (M): determina a quantidade de soluto, em mols, presente em dado volume de solução. Alternativamente, pode ser chamada de molaridade e a unidade utilizada é mol/L.
\(M=\frac{\text{nº de mols do soluto} (mol)}{\text{volume da solução}(L)}\)
Observação: É possível fazer uma conversão direta entre as concentrações comum e molar por meio da expressão C = M∙MM, em que C é a concentração comum (em g/L), M é a molaridade (em mol/L), e MM é a massa molar do soluto (em g/mol).
- Unidades percentuais: determinam o percentual mássico ou volumétrico de soluto na solução.
- Porcentagem massa/massa (%m/m): apresenta a participação em massa de soluto presente em 100 partes de solução. A unidade %m/m é adimensional, ou seja, as unidades de massa do soluto e da solução devem ser iguais.
\(\text{%} m/m=\frac{\text{massa do soluto}}{\text{massa da solução}}\cdot 100\)
-
- Porcentagem volume/volume (%V/V): apresenta a participação em volume de soluto presente em 100 partes de solução. A unidade %V/V é adimensional, ou seja, as unidades de volume do soluto e da solução devem ser iguais.
\(\text{%} V/V=\frac{\text{volume do soluto}}{\text{volume da solução}}\cdot 100\)
-
- Porcentagem massa/volume (%m/V): apresenta a participação mássica de soluto, em gramas, presente em 100 mL de solução.
\(\text{%} m/V=\frac{\text{massa do soluto}}{100 mL\ \text{da solução}}\cdot 100\)
- Fração molar (x): determina a quantidade de determinado constituinte dividido pela quantidade total de todos os constituintes da solução. A fração molar é também um parâmetro adimensional. Para determinada solução formada por um número n mols de soluto (n1) e n mols de solvente (n2), a fração molar do soluto (x1) será dada por:
\(x_1=\frac{n_1}{n_1+n_2}\)
- Parte por milhão (ppm): determina o número de partes de soluto, em unidade de massa ou volume, presente em 1 milhão de partes de solução.
\(1 ppm=\frac{\text{1 parte de soluto}}{10^6 \text{partes de solução}}\)
Para que o ppm seja corretamente determinado, a unidade do denominador precisa ser 1 milhão de vezes maior que a unidade do numerador. Por exemplo, 1 quilograma é 1 milhão de vezes maior que 1 miligrama, assim sendo, a unidade mg/kg é adequada para se interpretar o ppm. O mesmo serviria para a unidade mL/m3, uma vez que 1 m3 é equivalente a 1 milhão de mililitros.
Diluição das soluções
A diluição é uma operação feita em soluções para que elas diminuam a sua concentração. É realizada por meio da adição de solvente. A forma de se quantificar a queda da concentração durante uma diluição é perceber que a quantidade de soluto não se altera durante o processo, portanto:
massa inicial de soluto = massa final de soluto
A concentração comum é dada pela expressão C = m/V; isolando a massa, temos que m = C ∙ V, portanto:
Cinicial ∙ Vinicial = Cfinal ∙ Vfinal
Podemos fazer o mesmo para o número de mols do soluto:
nº de mols inicial de soluto = nº de mols final de soluto
A concentração molar é dada pela expressão M = n/V; isolando o número de mols, temos que n = M ∙ V, portanto:
Minicial ∙ Vinicial = Mfinal ∙ Vfinal
Outro ponto importante é que podemos considerar o seguinte balanço de volume durante a diluição:
Vfinal = Vinicial + Vsolvente

Mistura das soluções
Ao se misturar soluções, pode-se optar pela mistura de soluções com solutos iguais ou diferentes. Se os solutos forem iguais, uma reação química não ocorre, mas, se os solutos forem diferentes, uma reação química pode acontecer, trazendo uma nova interpretação para o sistema final.
→ Mistura de soluções com mesmo soluto
Neste caso, a quantidade de soluto, em massa ou em mols, se soma. Por exemplo, para a mistura de n soluções, as massas dos solutos se somam da seguinte forma:
m1 + m2 + ... + mn = mfinal
Por meio da fórmula de concentração comum, C = m/V, podemos calcular a concentração final após a mistura:
C1 ∙ V1 + C2 ∙ V2 + ... + Cn ∙ Vn = Cfinal ∙ Vfinal
Podemos fazer o mesmo para concentração molar, em que:
n1 + n2 + ... + nn = nfinal
Assim, a variação da concentração molar é dada por:
M1 ∙ V1 + M2 ∙ V2 + ... + Mn ∙ Vn = Mfinal ∙ Vfinal
O volume final também é considerado como um somatório dos volumes de todas as soluções participantes da mistura.
V1 + V2 + ... + Vn = Vfinal
→ Mistura de soluções com solutos diferentes
A partir de agora, a mistura pode desencadear ou não em uma reação química.
-
Quando não há reação química
Caso não haja uma reação química, cada soluto sofre uma diluição independente, porém tendo o mesmo volume final. Então, por exemplo, se misturarmos duas soluções, as quais identificaremos pelas letras A e B, a concentração final dos solutos A e B será dada por uma fórmula de diluição:
CA, inicial ∙ VA = CA, final ∙ Vfinal
CB, inicial ∙ VB = CB, final ∙ Vfinal
Ou, em termos de concentração molar:
MA, inicial ∙ VA = MA, final ∙ Vfinal
MB, inicial ∙ VB = MB, final ∙ Vfinal
O volume final da mistura poderá ser considerado como a soma do volume da solução A com o da solução B.
Vfinal = VA + VB
-
Quando há reação química
Caso haja uma reação química, a concentração final deverá ser determinada pela estequiometria da reação. Um exemplo clássico ocorre para reações de neutralização (ácido-base). Peguemos, por exemplo, a neutralização do hidróxido de sódio, NaOH, por ação do ácido sulfúrico, H2SO4.
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
A estequiometria da reação diz que, para cada 1 mol de ácido, são necessários 2 mols de base.
1 mol H2SO4 ------------ 2 mols de NaOH
Essa, portanto, é a proporção molar básica para o processo reacional, a qual se mantém para qualquer quantidade de mols (n), portanto:
1 mol H2SO4 ------------ 2 mols de NaOH
n mol H2SO4 ------------ n mols de NaOH
Dessa regra de três, tiramos a relação de reação entre o ácido e a base:
2 ∙ nH2SO4 = 1 ∙ nNaOH
Com essa relação, é possível calcular as necessidades de concentração e o volume de cada solução reagente, uma vez que M = n/V; logo, n = M∙V:
2 ∙ MH2SO4 ∙ VH2SO4 = MNaOH ∙ VNaOH
A questão é que essa relação de reação mudará de acordo com a reação, portanto, ela deve ser sempre determinada. As misturas com reação química servem como base teórica para a técnica de titulação volumétrica, importante método analítico de controle de qualidade.
Saiba mais: Como fazer cálculos estequiométricos
Exercícios resolvidos sobre soluções
Questão 1. (Albert Einstein/2025) Muitos atletas empregam em suas dietas um suplemento alimentar de proteína do soro do leite, denominado whey protein, comercializado na forma de pó, para ser misturado em água. Considere uma embalagem que contenha uma colher medidora e que apresente as seguintes instruções de preparo na forma do infográfico:
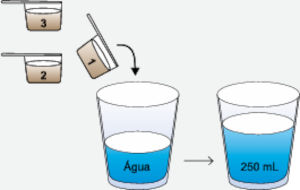
No preparo da bebida, são usadas 3 medidas de whey protein. Cada colher medidora contém 7,5 g de proteína.
A concentração em massa de proteína na bebida preparada de acordo com as instruções da embalagem é igual a
- 30,0 g/L.
- 63,5 g/L.
- 22,5 g/L.
- 7,5 g/L.
- 90,0 g/L.
Resposta: Letra E
Como são usadas 3 medidas e cada medida tem 7,5 g de proteína, então a massa total de proteína é de 22,5 g. Com um volume de 250 mL (0,25 L), a concentração é dada por:
\(C=\frac{massa}{volume}=\frac{22,5g}{0,25L}=90g/L\)
Questão 2. (Uece 2ª fase 2º dia/2024.2) Para efetuar os cálculos das concentrações das soluções, é fundamental o coeficiente de solubilidade, que está relacionado com as quantidades do soluto, solvente e das condições da temperatura. Atente para o que se afirma a seguir sobre as concentrações das soluções, e assinale com V o que for verdadeiro e com F o que for falso.
( ) Na solução insaturada, a quantidade de soluto é menor do que o estabelecido pelo coeficiente de solubilidade.
( ) Solução saturada é aquela em que a quantidade de soluto ultrapassa o coeficiente de solubilidade.
( ) Solução supersaturada é aquela em que o sistema é estável, pois a quantidade de solvente é maior do que a estabelecida pelo coeficiente de solubilidade.
( ) Na solução diluída, a quantidade de soluto é muito pequena em relação à de solvente, ficando bem abaixo do estabelecido pelo coeficiente de solubilidade.
A sequência correta, de cima para baixo é:
- F, V, F, V.
- V, F, V, F.
- F, V, V, F.
- V, F, F, V.
Resposta: Letra D.
A segunda afirmativa é falsa, pois na solução saturada a quantidade de soluto é igual à quantidade estabelecida pelo coeficiente de solubilidade.
A terceira afirmativa é falsa, pois uma solução supersaturada é um sistema instável.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.






