Soluto e solvente são as substâncias que formam uma solução. O solvente é a substância dominante, responsável pelo estado físico da solução e por dispersar as demais substâncias, as quais são chamadas de soluto. As soluções, por conta disso, podem ser tanto sólidas quanto líquidas, embora alguns autores também reconheçam misturas gasosas como soluções.
Soluto e solvente são parâmetros importantes de uma solução, pois a sua análise permite a determinação do coeficiente de solubilidade, a classificação das soluções, bem como o cálculo das unidades de concentração.
Leia também: Afinal, o que é uma mistura?
Tópicos deste artigo
- 1 - Resumo sobre soluto e solvente
- 2 - O que é soluto e solvente?
- 3 - Exemplos de soluto e solvente
- 4 - Classificação de soluções
- 5 - Concentração de soluções
- 6 - Coeficiente de solubilidade
- 7 - Exercícios resolvidos sobre soluto e solvente
Resumo sobre soluto e solvente
-
Soluto e solvente são as substâncias que formam a solução.
-
O solvente é a substância dominante da solução.
-
Soluto é a substância que será dispersa pela ação do solvente.
-
As soluções podem ser sólidas ou líquidas, a depender do estado físico do solvente; insaturadas, saturadas ou supersaturadas, de acordo com a quantidade de soluto dissolvida.
-
Alguns autores também reconhecem misturas gasosas como soluções.
-
Soluto e solvente são parâmetros importantes para classificar as soluções qualitativamente e para determinar o coeficiente de solubilidade e a concentração.
O que é soluto e solvente?
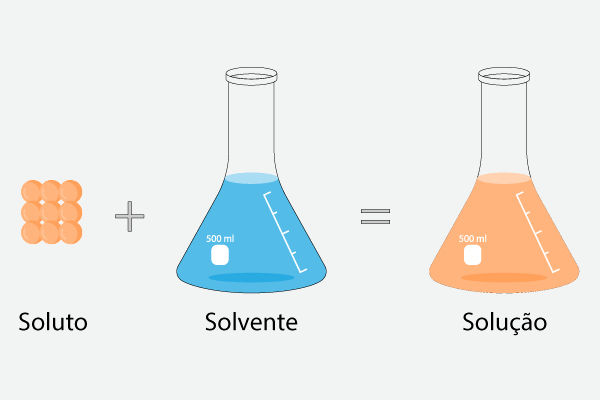
Soluto e solvente são as substâncias que, juntas, compõem uma solução. O solvente é a substância dominante da solução, utilizado para dispersar as demais substâncias da solução, as quais são conhecidas como soluto.
Exemplos de soluto e solvente

-
Soro fisiológico: cloreto de sódio (soluto) e água (solvente).
-
Bronze: estanho (soluto) e cobre (solvente).
-
Gasolina comercial: álcool etílico (soluto) e gasolina (solvente).
-
Água mineral: sais minerais e oligoelementos (solutos) e água (solvente).
-
Soro caseiro: sal e açúcar (solutos) e água (solvente).
-
Álcool 70 °INPM: álcool etílico (soluto) e água (solvente).
Veja também: O que é uma substância pura?
Classificação de soluções
As soluções podem ser classificadas de duas formas: quanto ao estado físico dominante e quanto à quantidade de soluto dissolvida.
→ Quanto ao estado físico dominante
Nesse caso, a solução será classificada de acordo com o estado físico do solvente, o qual é dominante na solução. Assim sendo:
-
soluções líquidas são as soluções em que o solvente utilizado é um líquido;
-
soluções sólidas são as soluções em que o solvente utilizado é um sólido.
Alguns autores não consideram as misturas gasosas como soluções, mas outros sim. Dessa forma, toda mistura gasosa é uma solução (já que não existe mistura gasosa heterogênea).

→ Quanto à quantidade de soluto dissolvida
De acordo com a quantidade de soluto dissolvida, uma solução pode ser classificada como insaturada, saturada ou supersaturada. Soluções insaturadas são soluções em que a quantidade de soluto dissolvida é a menor que a estabelecida pelo coeficiente de solubilidade naquela temperatura. Nesse caso, ainda é possível dissolver mais soluto.
Já as soluções saturadas são soluções em que a quantidade de soluto dissolvida é exatamente a mesma que a estabelecida pelo coeficiente de solubilidade naquela temperatura. Não há como dissolver uma quantidade adicional de soluto. Quando se coloca um soluto sólido em uma solução líquida saturada, o soluto vai ao fundo do recipiente, sendo chamado de corpo de fundo ou precipitado. Em técnicas laboratoriais, a formação do precipitado é uma garantia de saturação da solução.
Por fim, soluções supersaturadas são aquelas soluções em que se consegue dissolver acima do permitido pelo coeficiente de solubilidade naquela temperatura. Tais soluções são instáveis e são alcançadas apenas por meio de técnicas específicas. Uma forma clássica é mudar a temperatura da solução (por exemplo, aquecendo-a) para assim aumentar a solubilidade do soluto.
Posteriormente, deixa-se a solução chegar, gradativa e lentamente, na temperatura de início. Esse quadro permite que o soluto se mantenha dissolvido, mesmo numa temperatura em que não deveria estar. Contudo, uma leve agitação ou perturbação no sistema faz com que a solução torne a ser o que deveria naquela temperatura. No caso de solutos gasosos, a alteração da pressão também pode influenciar na alteração da solubilidade.
Cervejas são exemplos de soluções supersaturadas. O gás carbônico (que forma a espuma) é mantido acima do coeficiente de solubilidade por meio da pressão.

Concentração de soluções
A quantidade de soluto dissolvida em uma solução pode ser mensurada por meio de unidades de concentração. Valores de concentração permitem comparar soluções quanto à quantidade de soluto dissolvida, permitindo dizer se uma solução é mais ou menos concentrada que outra, ou, ainda, se é mais ou menos diluída que outra.
Algumas unidades de concentração mais utilizadas estão expostas a seguir.
-
Concentração comum: apresenta a massa de soluto pelo volume de solução. Geralmente possui a unidade g/L.
\(C=\frac{\text{massa do soluto(g)}}{\text{Volume da solução(L)}}\)
-
Concentração molar (ou molaridade): apresenta o número de mols de soluto pelo volume da solução. Geralmente possui a unidade mol/L.
\(M=\frac{\text{nº de mols do soluto(mol)}}{\text{Volume da solução(L)}}\)
-
Porcentagem em massa: apresenta as unidades de massa de soluto presente em 100 unidades de massa de solução. Essa unidade de concentração é adimensional, o que quer dizer que ambas as unidades de massa utilizadas devem ser iguais.
\(\%m/m=\frac{\text{massa do soluto}}{\text{massa da solução}}\cdot 100\)
-
Porcentagem em volume: apresenta as unidades de volume de soluto presente em 100 unidades de volume de solução. É uma unidade de concentração adimensional e, portanto, ambas as unidades de volume utilizadas devem ser iguais.
\(\%V/V=\frac{\text{volume do soluto}}{\text{volume da solução}}\cdot 100\)
-
Porcentagem massa/volume: apresenta a massa de soluto, em gramas, presente em 100 mL de solução.
\(\%m/V=\frac{\text{massa do soluto(g)}}{\text{100mL da solução}}\cdot 100\)
-
Fração molar (x): apresenta a participação em quantidade de matéria de um soluto em relação ao número total de mols de constituintes da solução. A fração molar também é uma unidade de concentração adimensional.
\(x_1=\frac{n_1}{n_1+n_2}\)
Nesse caso, n1 é o número de mols do soluto e n2 é o número de mols do solvente.
-
Parte por milhão (ppm): apresenta as unidades de soluto, em massa ou volume, em 1 milhão de partes de solução.
\(1ppm=\frac{\text{1 parte de soluto}}{10^6 \text{partes de solução}}\)
Coeficiente de solubilidade
A quantidade máxima de soluto que uma quantidade específica de solvente é capaz de dissolver, em uma dada temperatura, é chamada de coeficiente de solubilidade. O coeficiente de solubilidade é um dado experimental. A seguir, são listados alguns valores de coeficiente de solubilidade de compostos inorgânicos para soluções aquosas (em que a água é o solvente) a 25 °C. A quantidade de água é de 100 gramas.
|
Soluto |
Coeficiente de solubilidade (g/100 g H2O) a 25 °C |
|
Al2(SO4)3 |
38,5 |
|
Ba(OH)2 |
4,9 |
|
CaSO4 |
0,2 |
|
CsCl |
191,0 |
|
FeCl3 |
91,2 |
|
Hg2Cl2 |
4,0 x 10−4 |
|
KNO3 |
38,3 |
|
KCl |
35,5 |
|
LiF |
0,1 |
|
MgBr2 |
102,4 |
|
NH4NO3 |
212,5 |
|
NaCl |
35,9 |
|
NaOH |
100,0 |
|
PbCl2 |
1,1 |
Saiba mais: Quais são os métodos de separação de misturas?
Exercícios resolvidos sobre soluto e solvente
Questão 1. (UERJ/2025) Recentemente, a prefeitura de Maceió-AL decretou situação de emergência diante do iminente colapso em uma das minas de sal-gema do município. A exploração dessas minas envolve a escavação de poços até a camada de sal, que pode estar a mais de mil metros de profundidade. Então, injeta-se água para dissolver o sal-gema e formar uma solução saturada, que será trazida, por pressão, até a superfície.
Adaptado de agenciabrasil.ebc.com.br, 03/12/2023.
Sabe-se que o principal componente do sal-gema é o cloreto de sódio, cuja solubilidade em água é de 36 g de NaCl por 100 g de H2O, à temperatura de 20 °C.
A essa mesma temperatura, a quantidade de matéria, em mols, de cloreto de sódio dissolvido em 2000 kg de água, formando uma solução saturada, corresponde aproximadamente a:
-
12300
-
24600
-
36900
-
61500
Resposta: Letra A.
O coeficiente de solubilidade do NaCl em água, na temperatura de 20 °C, é de 36 g/100 g de H2O. Assim, em 2000 kg de água, a quantidade máxima de NaCl que pode ser dissolvida é, proporcionalmente, igual a 720000 gramas. Como a massa molar do NaCl é de 58,5 g/mol, é possível dizer que em 720000 gramas há:
\(n = \frac{massa}{\text{massa molar}}\\ n = \frac{720000}{58,5}\\ n = 12307,7 mols\\ n ≈ 12300 mols\)
Questão 2. (UECE 2ª Fase 2º dia/2024.2) Para efetuar os cálculos das concentrações das soluções, é fundamental o coeficiente de solubilidade, que está relacionado com as quantidades do soluto, solvente e das condições da temperatura. Atente para o que se afirma a seguir sobre as concentrações das soluções, e assinale com V o que for verdadeiro e com F o que for falso.
( ) Na solução insaturada, a quantidade de soluto é menor do que o estabelecido pelo coeficiente de solubilidade.
( ) Solução saturada é aquela em que a quantidade de soluto ultrapassa o coeficiente de solubilidade.
( ) Solução supersaturada é aquela em que o sistema é estável, pois a quantidade de solvente é maior do que a estabelecida pelo coeficiente de solubilidade.
( ) Na solução diluída, a quantidade de soluto é muito pequena em relação à de solvente, ficando bem abaixo do estabelecido pelo coeficiente de solubilidade.
A sequência correta, de cima para baixo é:
-
F, V, F, V.
-
V, F, V, F.
-
F, V, V, F.
-
V, F, F, V.
Resposta: Letra D.
A segunda afirmativa é falsa, pois nas soluções saturadas a quantidade de soluto é igual à quantidade estabelecida pelo coeficiente de solubilidade.
A terceira afirmativa é falsa, pois as soluções supersaturadas são sistemas instáveis, onde a quantidade de soluto é maior que a estabelecida pelo coeficiente de solubilidade.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.







