Conforme a explicação do texto Saturação das Soluções, as soluções químicas são formadas pela dissolução de um soluto em um solvente. Cada soluto possui um coeficiente de solubilidade específico, que é a quantidade máxima de soluto dissolvível em determinada quantidade de solvente a uma dada temperatura.
Construção de um gráfico com curva de solubilidade
Por exemplo, o coeficiente de solubilidade do KNO3 é 31,2 g em 100 g de água a 20 ºC. Se dissolvermos exatamente essa quantidade de nitrato de potássio em 100 g de água a 20 ºC, uma solução saturada. Qualquer quantidade adicional desse sal vai precipitar-se (forma um corpo de fundo no recipiente).
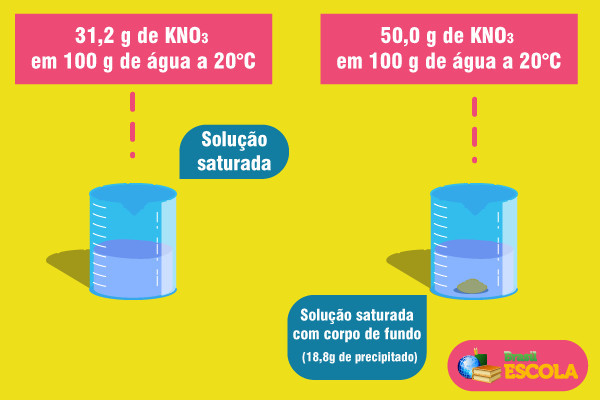
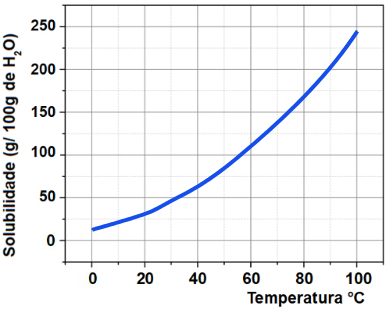
No entanto, o coeficiente de solubilidade varia com a temperatura. Assim, se aquecermos essa solução saturada com corpo de fundo de KNO3, o precipitado gradualmente se dissolverá na água. Observe a seguir os valores dos coeficientes de solubilidade do KNO3 em 100 g de água em diferentes temperaturas:
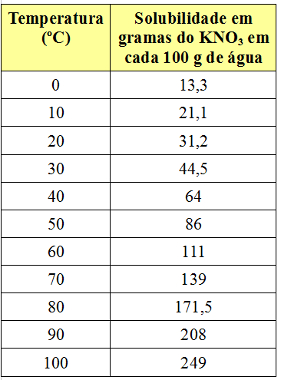
Observe que a solubilidade desse sal em água aumenta com o aumento da temperatura. Na maioria das substâncias, isso também acontece. Se colocarmos esses valores em um gráfico, teremos o seguinte:
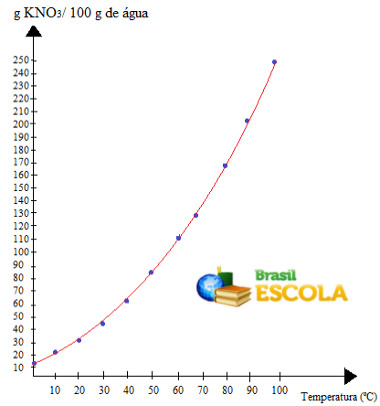
Essa é a chamada curva de solubilidade do KNO3. Dizemos que ela é ascendente porque cresce com o aumento da temperatura.
Características das curvas de solubilidade dos solutos em um gráfico
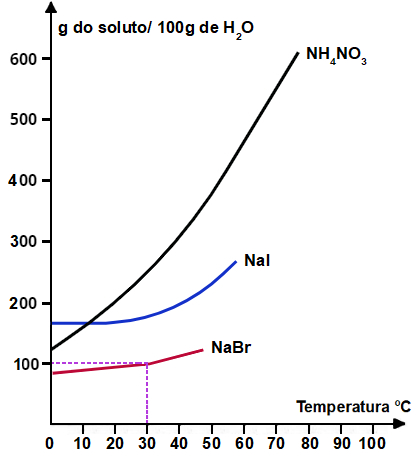
Cada substância possui a sua curva de solubilidade para determinado solvente. Algumas dessas substâncias têm a solubilidade diminuída com o aumento da temperatura, como é o caso do CaCrO4, que possui curva de solubilidade descendente. Isso significa que, se aquecermos uma solução saturada desse sal, parte do sal dissolvido precipitar-se-á.
Já para outras substâncias, o aumento da temperatura não interfere tanto na solubilidade, como ocorre com uma solução de sal de cozinha (NaCl). Em 20 ºC, o coeficiente de solubilidade do NaCl é de 36 g em 100 g de água, mas, se aumentarmos a temperatura para 100ºC, essa solubilidade aumentará somente para 39,8 g, um aumento muito pequeno.
Existem também substâncias em que a solubilidade aumenta somente até certo ponto do aumento de temperatura, pois, depois dele, a solubilidade diminui. Isso acontece, por exemplo, com substâncias hidratadas, que, ao ser aquecidas, chegam a um momento em que desidratam. Por isso, como a sua composição muda, a sua variação de solubilidade com a temperatura também muda. Essa ocorrência pode ser observada no gráfico por meio de inflexões na curva de solubilidade.
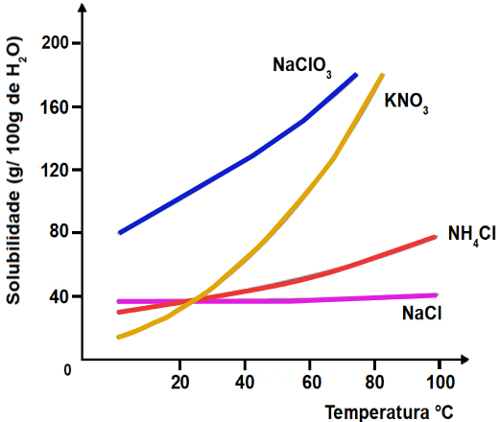
A seguir, apresentamos um gráfico com as curvas de solubilidade de várias substâncias:
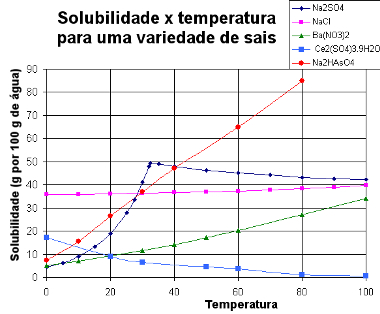
Curvas de solubilidade de diversos sais
Por meio desse tipo de gráfico, podemos comparar as solubilidades de diversos sais em um mesmo solvente e nas mesmas temperaturas.
Classificação de uma solução por meio de um gráfico com curva de solubilidade
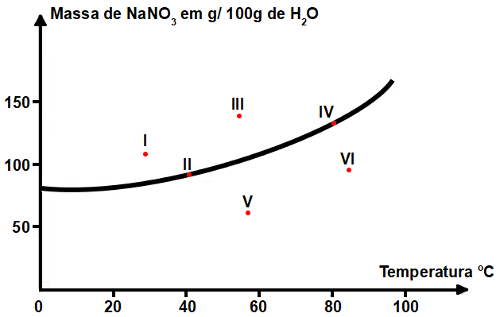
As curvas de solubilidade também ajudam a determinar a saturação das soluções, ou seja, se elas são insaturadas, saturadas, saturadas com corpo de fundo ou supersaturadas. Veja um exemplo:
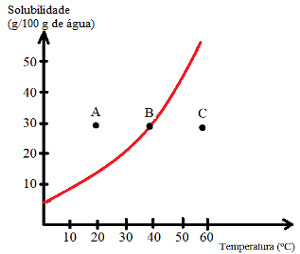
Veja quais são os tipos de solução indicados pelos pontos A, B e C:
-
A: Saturada com corpo de fundo. No ponto A, 30 g de soluto são dissolvidos em 100 g de água a 20ºC. A curva mostra que nesse ponto o coeficiente de solubilidade é cerca de 15 g/100 g de água. Assim, como a quantidade de soluto presente é maior, obtém-se uma solução saturada com corpo de fundo.
Não pare agora... Tem mais depois da publicidade ;) -
B: Saturada. O ponto B está localizado exatamente na curva de solubilidade, o que indica que a solução é saturada, pois há 30 g de soluto dissolvidos em 100 g de água a 40ºC. Esse é, então, exatamente o coeficiente de solubilidade desse soluto nessa temperatura.
-
C: Insaturada. Há 30 g de soluto dissolvidos em 100 g de água a 60ºC. A curva mostra que nesse ponto o coeficiente de solubilidade é maior que 50 g/100 g de água. Assim, como a quantidade de soluto dissolvida é menor que o coeficiente de solubilidade, há uma solução insaturada.
Assim, podemos concluir que:
-
Pontos acima da curva: soluções saturadas com corpo de fundo;
-
Pontos na curva: soluções saturadas;
-
Pontos abaixo da curva: soluções insaturadas.
Não pare agora... Tem mais depois da publicidade ;)
Por Jennifer Fogaça
Graduada em Química