Soluções são misturas de duas ou mais substâncias e apresentam um aspecto uniforme, ou seja, são homogêneas. Elas são formadas por um ou mais solutos (substâncias dissolvidas) e um solvente, que é a substância presente em maior quantidade e que dissolve as outras substâncias.
Na maioria das vezes, quando falamos de soluções, o que vem à mente são as soluções aquosas usadas em laboratórios, como as mostradas na imagem acima. Elas geralmente são formadas por um soluto sólido ou líquido dissolvido na água.
No entanto, não são apenas esses tipos de soluções químicas que existem, mas muitas outras, que podem ser classificadas de acordo com três critérios principais:
-
Estados físicos do soluto e do solvente;
-
Natureza do soluto.
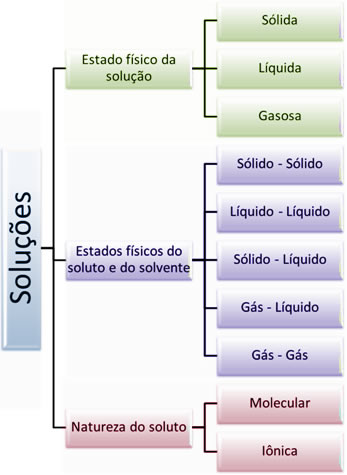
Segundo cada um desses critérios, as soluções podem ser classificadas em:
→ Soluções sólidas
As soluções sólidas são formadas apenas por solutos e solventes sólidos. No cotidiano, os principais exemplos desse tipo de solução são as ligas metálicas. A medalha a seguir, por exemplo, foi produzida com a liga de bronze, que é uma mistura de aspecto homogêneo formada por estanho e cobre.

Uma medalha de bronze é uma solução sólida
→ Soluções Líquidas
As soluções líquidas possuem o solvente líquido, geralmente a água, e os solutos podem ser sólidos, líquidos ou gasosos.
a) Sólido – Líquido
Quando misturamos sal ou açúcar (sólidos) na água (líquido), temos um exemplo desse tipo de solução. Outros exemplos são: água do mar, que é formada por vários sais dissolvidos nela; o álcool iodado (tintura de iodo), que contém iodo dissolvido em álcool; e o soro fisiológico (solução aquosa com 0,9% em massa de cloreto de sódio – sal de cozinha).

O soro fisiológico é uma solução sólido-líquido
b) Líquido - Líquido
Tanto o soluto quanto o solvente são líquidos. Alguns exemplos são: água oxigenada, que é uma solução aquosa de peróxido de hidrogênio, e o álcool desinfetante ou álcool combustível, que é uma mistura de álcool e água.

O álcool hidratado é uma solução líquido-líquido
c) Gás - Líquido
O soluto é um gás e o solvente é um líquido. Exemplos: águas de aquários, mares, lagos e rios possuem os gases do ar dissolvidos, permitindo que os seres aquáticos sobrevivam. Além disso, os refrigerantes e a água com gás possuem o gás carbônico dissolvido.
.jpg)
A água com gás é uma solução gás-líquido
→ Soluções gasosas
Esse tipo de solução é formado pela mistura apenas de gases. O ar é um exemplo, pois sua composição aproximada é de 78% de gás nitrogênio, 21% de gás oxigênio e 1% de outros gases.

O ar atmosférico é uma solução gasosa
→ Soluções moleculares
São aquelas que possuem solutos moleculares que apenas se dissolvem em água e geram uma solução não eletrolítica, ou seja, que não conduz eletricidade. Um exemplo é a água com açúcar.
→ Soluções iônicas
Essas soluções são eletrolíticas, conduzem eletricidade e sua formação pode ocorrer de duas formas:
-
Quando colocamos solutos iônicos na água e eles sofrem uma dissociação iônica, ou seja, os seus íons são separados e ficam no meio aquoso. Exemplo: sal de cozinha (cloreto de sódio – NaCl – na água);
-
Quando colocamos solutos moleculares que reagem com a água, sofrendo ionização, ou seja, originam íons que ficam no meio aquoso. Exemplo: cloreto de hidrogênio (HCl) na água.
Por Jennifer Fogaça
Graduada em Química
