A solubilidade pode ser definida como a máxima quantidade possível de um soluto que pode ser dissolvida em certa quantidade de solvente a uma dada temperatura.
Essa quantidade máxima que pode ser dissolvida é também conhecida por coeficiente de solubilidade ou grau de solubilidade. Mas, a solubilidade de qualquer substância depende, entre outras coisas, do tipo de solvente no qual o soluto está disperso.
Por exemplo, o NaCl (cloreto de sódio - sal de cozinha) é bem solúvel em água, sendo que em 1 L de água a 20ºC, conseguimos solubilizar até 360 gramas desse sal. Mas, quando o solvente muda para a gasolina, nas mesmas condições de volume, temperatura e pressão, o sal não se dissolve.
Por que a solubilidade de uma substância varia tanto de um solvente para outro?
Um dos fatores é a polaridade dos compostos envolvidos. No exemplo citado, temos que o sal é polar, a água também é polar e a gasolina é apolar. O sal é formado por átomos de sódio (Na) e cloro (Cl) que se ligam por meio de ligações iônicas, em que o sódio doa definitivamente um elétron para o cloro, formando os íons Na+ e Cl-. Como esses íons possuem cargas opostas, eles se atraem e se mantêm unidos (Na+Cl-).
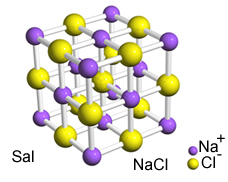
Isso nos mostra que o sal é realmente polar, toda ligação iônica é polar, pois existe a diferença de carga elétrica no composto.
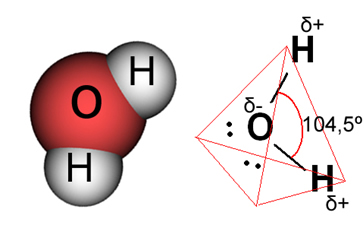
Já no caso da água, a ligação existente é covalente, na qual dois átomos de hidrogênio compartilham elétrons com um átomo de oxigênio. A molécula de água possui dois dipolos, com o oxigênio tendo a carga parcialmente negativa e o hidrogênio com a carga parcialmente positiva (δ- O ─ H δ+). Mas, esses dipolos não se cancelam, porque a molécula de água se encontra em um ângulo de 104,5º, mostrando que a distribuição e carga ao longo da molécula não são uniformes. Há uma maior densidade de carga negativa sobre o átomo de oxigênio da molécula. Isso nos mostra que a molécula de água é realmente polar.
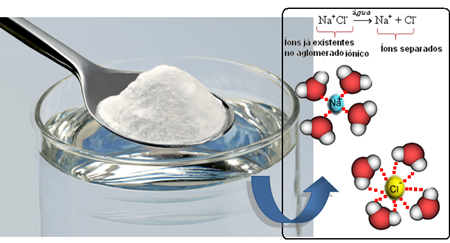
Assim, quando misturamos o sal na água, a parte positiva do sal, que são os cátions Na+, é atraída pela parte negativa da água, que é o oxigênio, e a parte negativa do sal (ânions Cl-) é atraída pela parte positiva da água (H+). Consequentemente, a união Na+Cl- é desfeita, solubilizando o sal na água.
Já a gasolina é formada por uma mistura de diferentes hidrocarbonetos, sendo eles apolares, ou seja, a distribuição da carga elétrica da gasolina é uniforme. Assim, não há interação dos íons do sal com a gasolina e ele não se dissolve.
Esses e outros casos parecidos nos levam à seguinte conclusão:

Entretanto, essa não pode ser considerada uma regra geral, pois existem muitos casos de solutos apolares que se dissolvem bem em solventes polares e vice-versa. Desse modo, para entender por que isso ocorre, temos que considerar ainda outro fator: o tipo de força intermolecular do solvente e do soluto.
Lei sobre isso no texto: “Relação entre Força Intermolecular e Solubilidade das Substâncias”.
Por Jennifer Fogaça
Graduada em Química

