O texto Titulação mostrou como é realizada essa técnica de análise volumétrica, que tem como principal objetivo identificar a concentração de uma solução por meio da sua reação com outra solução de concentração conhecida.
Agora, veremos como utilizar os dados obtidos na titulação para chegar à concentração desejada, que pode ser de um ácido ou de uma base em solução. Para tal, seguem-se basicamente três passos:
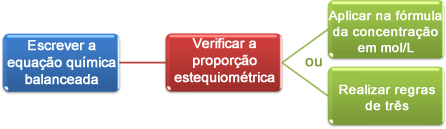
Vejamos um exemplo:
Digamos que um químico tinha uma solução de ácido acético (vinagre (CH3COOH(aq))) e queria descobrir a sua concentração em mol/L. Então, ele colocou 20,0 mL de vinagre (titulado) em um erlenmeyer e adicionou o indicador fenolftaleína. Depois ele encheu uma bureta de 100 mL com hidróxido de sódio (NaOH) de concentração conhecida (titulante) igual a 1,0 mol/L. Por fim, o químico realizou a titulação e percebeu que a mudança de cor (ponto de viragem - momento em que ele parou a titulação) ocorreu quando foram consumidos 24 mL de NaOH.
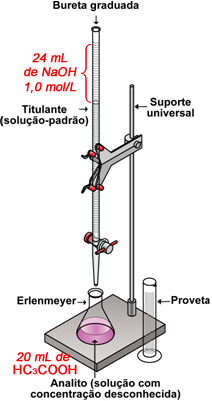
Com base nesse experimento, ele obteve os seguintes dados:
MCH3COOH= ?
VCH3COOH = 20 mL = 0,02 L
MNaOH = 24 mL = 0,024 L
VNaOH = 1,0 mol/L
Sendo que M = concentração em mol/L e V = volume em L.
Para descobrirmos a concentração do ácido acético, temos que primeiramente saber escrever a equação química que representa a reação de neutralização que ocorreu devidamente balanceada. Nesse caso, a reação é a seguinte:
1 CH3COOH(aq) + 1 NaOH(aq) → 1 NaC2H3O2(aq) + 1 H2O(ℓ)
Essa parte é importante para vermos a proporção estequiométrica em que os reagentes reagem. Observe que a proporção é de 1 : 1, ou seja, para cada mol de ácido acético, é necessário 1 mol de hidróxido de sódio.
Agora podemos proceder com os cálculos de duas formas:
(1ª) Por meio da fórmula: M1. V1 = M2 . V2
Visto que a proporção estequiométrica é de 1 : 1, temos que: nCH3COOH = nNaOH .
Sendo M = n/V → n = M . V. Desse modo, chegamos à relação acima, que pode, nesse caso, ser escrita assim: MCH3COOH . CH3COOH = MNaOH . VNaOH
Assim, basta substituir os valores dessa fórmula:
MCH3COOH . V CH3COOH = MNaOH . VNaOH
MCH3COOH . 0,02 L = 1,0 mol/L . 0,024 L
MCH3COOH = 0,024 mol
0,02 L
MCH3COOH = 1,2 mol/L
Portanto, a concentração inicial da solução de ácido acético, nosso titulado, era de 1,2 mol/L.
Observação importante: Se a proporção estequiométrica não fosse de 1 : 1, bastaria multiplicar a concentração em mol/L (M) das substâncias pelos seus respectivos coeficientes. Por exemplo, se a proporção fosse de 1 : 2, teríamos o seguinte:
M1. V1 = 2 . M2 . V2
Mas veja outra maneira de realizar esses cálculos:
(2ª) Por meio de regras de três:
1 CH3COOH(aq) + 1 NaOH(aq) → 1 CH3COONa(aq) + 1 H2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1 . 60g 1 . 40 g 1 . 82 g 1 . 18 g
Essas massas são as massas moleculares calculadas para cada substância.
* Sabendo que o volume gasto da solução 1,0 mol/L de NaOH(aq) foi 24 mL, podemos descobrir primeiro a quantidade de matéria (mol) de NaOH que reagiu:
1 mol de NaOH → 1,0 L
1 mol de NaOH -------- 1000 mL
x -------------- 24 mL
x = 0,024 mol de NaOH
* Visto que a proporção é de 1 : 1, a quantidade de matéria (mol) de ácido acético deve ser a mesma do NaOH: 0,024 mol.
Observação: Se a proporção estequiométrica fosse diferente, então, levaríamos isso em consideração nessa parte. Por exemplo, se fosse 1:3 e a quantidade de matéria de uma espécie química reagente fosse igual a 0,024 mol, então a da outra substância seria o triplo: 0,072.
* Agora, calculamos:
20 mL de vinagre --------- 0,024 mol de ácido acético
1000 mL de vinagre------- y
y = 1,2 mol
Ou seja, há 1,2 mol/L, que é o mesmo valor que obtivemos no método anterior.
Por Jennifer Fogaça
Graduada em Química
