No texto “Título ou Porcentagem em Massa” nós vimos como calcular a relação entre a massa do soluto e a massa da solução, para soluções sólidas, líquidas e gasosas. Neste texto, porém, veremos que também é possível calcular o título em termos de volume, para soluções com componentes líquidos ou gasosos.

O título em volume pode ser calculado pela expressão:
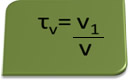
Considere como exemplo uma solução aquosa de álcool etílico usada como antisséptico e desinfetante, que foi preparada adicionando-se 70 mL de álcool puro à água suficiente para completar um volume de 100 mL de solução. Assim, temos:
τ = 70 mL = 0,7
100 mL
Podemos expressar o título em porcentagem também, apenas multiplicando o resultado por 100%. Portanto, nesse caso temos uma solução de álcool etílico a 70%, o que significa que, de cada 100 unidades de volume da solução, 70 unidades de volume são de álcool.
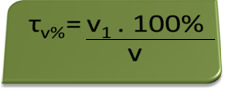
No caso abaixo, temos uma solução de álcool etílico a 70% em um volume de 250 mL de solução; o que quer dizer que 175 mL são de álcool, conforme os cálculos:
100 mL ------- 70 mL de álcool
250 mL ------- x
x = 70 . 250
100
X = 175 mL de álcool

No entanto, não podemos dizer que temos nesse caso 75 mL (250-175) de água. Diferentemente do título em massa, no qual podemos somar a massa do solvente com a massa do soluto para encontrar a massa da solução, isso não pode ser feito em relação ao título em volume.

Isso significa que o volume da solução não é igual à soma do volume do solvente com o volume do soluto (embora muitas vezes a diferença possa ser considerada desprezível). Isso ocorre porque as forças intermoleculares que existem nesses líquidos influenciam no volume final.
No caso da solução citada, de álcool etílico, por exemplo, quando misturamos o álcool com a água, ocorre uma contração do volume total da solução; ou seja, o volume final será menor do que se somássemos o volume do álcool e da água isolados. Isso se dá porque as moléculas de álcool estabelecem ligações ou pontes de hidrogênio com as moléculas da água, diminuindo os espaços entre elas.
Portanto, nesse e nos outros casos, o volume da solução deve ser medido experimentalmente quando não forem fornecidos no exercício.
A porcentagem em volume é muito utilizada em casos de bebidas alcoólicas e no álcool comercial, como o mencionado. Veja duas aplicações importantes desse cálculo:
- Bafômetro: o bafômetro mede a concentração de álcool etílico no sangue, sendo que no Brasil é proibido alguém conduzir qualquer tipo de veículo com teor alcoólico sanguíneo igual ou acima de 0,1 % em volume. Uma pessoa com esse teor alcoólico apresenta, para cada litro de sangue, 1 mL de álcool, conforme mostrado pelos cálculos a seguir:
τv%=V1. 100%
v
0,1 % = V1 . 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 mL
100%

- Teor de etanol na gasolina: no Brasil, a gasolina recebe de forma regulamentada a adição de etanol. Mas o teor de etanol na gasolina deve ser de no máximo 24% em volume de álcool anidro (já que a gasolina deve ser isenta de água). Quanto mais etanol é adicionado à gasolina, mais a cor do combustível vai clareando e sua densidade aumentando.
Por Jennifer Fogaça
Graduada em Química
