É possível estabelecer uma relação entre as quantidades de soluto dissolvido em determinada quantidade de solvente e em uma dada temperatura. Imagine que 10 g de sal foram misturados em 100 mL de água a 20ºC. O sal dissolve-se completamente e podemos até mesmo colocar mais sal que ele continuará dissolvendo-se.
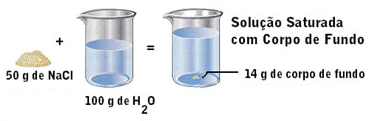
Se colocarmos 25 g de sal na mesma quantidade de água e na mesma temperatura, o sal também se dissolverá todo. No entanto, se colocarmos 50 g de sal em 100 mL de água a 20ºC, 14 g de sal não se solubilizarão, permanecendo no fundo do béquer. Essa parte não dissolvida é denominada de precipitado, corpo de chão ou corpo de fundo.
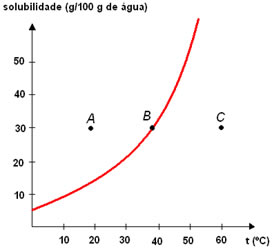
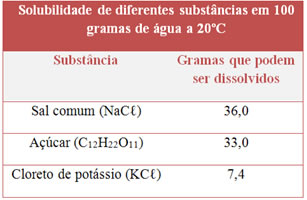
Por meio do último exemplo, vemos que existe uma quantidade limite ou quantidade máxima de soluto que se dissolve em determinada quantidade de solvente, o que chamamos de coeficiente de solubilidade. No caso do sal, o coeficiente de solubilidade é 36 g em 100 mL ou 100 g de água a 20º C. É por isso que, de 50 g, 14 g não se solubilizaram.
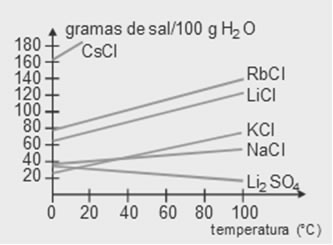
O coeficiente de solubilidade varia de acordo com o soluto, a quantidade de solvente e a temperatura em que se encontra a solução. Em relação à natureza do soluto, substâncias diferentes se dissolvem em quantidades diferentes em uma mesma quantidade de solvente e na mesma temperatura.
Se dissolvermos 100 g de açúcar, que é bem mais do que a quantidade de sal dissolvido, em 100 mL de água, a 20 ºC, todo o açúcar se dissolverá, o que significa que seu coeficiente de solubilidade é bem maior que o do sal.
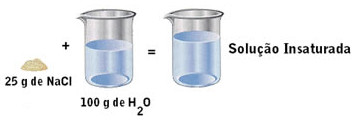
a) Solução insaturada
Quando colocamos uma quantidade de soluto abaixo de seu coeficiente de solubilidade, temos uma solução insaturada ou não saturada.
b) Solução saturada
Se colocarmos exatamente o coeficiente de solubilidade (36 g), teremos uma solução saturada, isto é, solução que contém a máxima quantidade de soluto em uma certa quantidade de solvente e em uma determinada temperatura.
No exemplo que demos em que se colocaram 50 g de sal e 14 g não se dissolveram, temos uma solução saturada com corpo de fundo. Para obter somente a solução saturada, basta realizar uma filtração.
c) Solução supersaturada
Agora, se nós aquecermos essa solução saturada com corpo de fundo, o precipitado dissolver-se-á totalmente, pois, a uma temperatura mais elevada, o seu coeficiente de solubilidade aumenta.
Se deixarmos essa solução em repouso, até ela voltar para a temperatura de 20 ºC, obteremos uma solução supersaturada, que é muito instável, pois contém mais soluto dissolvido do que o coeficiente de solubilidade naquela temperatura.
Assim, se adicionarmos a ela um pequeno cristal do soluto, ocorrerá a precipitação dos 14 g de sal, que é a quantidade dissolvida acima da quantidade possível para a saturação (36 g).
Ao adicionarmos um pequeno cristal a uma solução supersaturada de acetato de sódio, por exemplo, a cristalização inicia-se. Isso pode ser visto na figura a seguir:

Solução supersaturada preparada com acetato de sódio
Por Jennifer Fogaça
Graduada em Química