Ao preparar uma solução, isto é, ao dissolver um soluto em um dado solvente, as moléculas ou os íons do soluto separam-se, permanecendo dispersos no solvente.
Podemos estabelecer uma relação entre diferentes solutos e as características de suas soluções aquosas por meio de experimentos bem simples, feitos à mesma temperatura. Observe as situações a seguir:
A)
B)
Ao observarmos as soluções A e B, notamos que o sal é menos solúvel que o açúcar e, partindo desse fato, podemos generalizar:
Solução saturada: é a que contém a máxima quantidade de soluto em uma dada quantidade de solvente, a determinada temperatura; a relação entre a quantidade máxima de soluto e a quantidade de solvente é denominada coeficiente de solubilidade. Exemplo: A quantidade máxima de sal (NaCl), que se dissolve em 100 g de H2O a 20ºC, é 36 g; a solução é denominada saturada.
Uma solução com quantidade de soluto inferior ao coeficiente de solubilidade é denominada solução não-saturada ou insaturada.
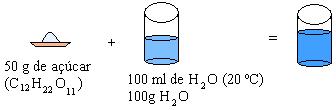
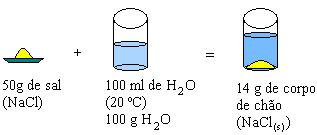




.jpg)