Uma mistura de soluções de mesmo soluto sem reação química consiste em reunir em um mesmo recipiente duas soluções com, por exemplo, cloreto de potássio (Kcl). Nesse tipo de mistura, nunca haverá a ocorrência de uma reação química em razão da presença de solutos iguais, ou seja, ambos apresentam o mesmo cátion e o mesmo ânion. Dessa forma, podemos afirmar que, quando realizamos uma mistura com essas características, estamos apenas somando as quantidades de soluto e solvente que formam ambas as soluções.
Se misturarmos, por exemplo, uma solução de 1L de água e 4 gramas de KI (iodeto de potássio) com outra de 2 L de água e 6 gramas de KI, teremos uma nova solução de 3L de água e 10 gramas de KI.
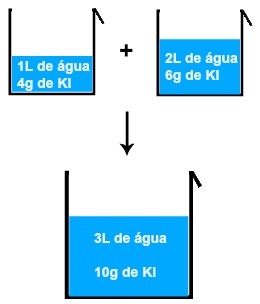
Resultado da mistura de duas soluções de iodeto de potássio
Analisando a imagem, podemos concluir que a massa do soluto (m1') da primeira solução é somada à massa do soluto (m1'') da segunda solução, resultando na massa do soluto (mF) na solução final (mistura):
m1' + m1'' = mF
No exemplo:
4 + 6 = 10 gramas
O mesmo acontece com o volume de água presente em cada solução, ou seja, o volume da primeira (V') somado ao volume da segunda (V'') resulta no volume final (VF):
V' + V'' = VF
No exemplo:
1 + 2 = 3 L
Como toda solução apresenta uma quantidade de soluto dissolvida e aqui temos a mistura de soluções de mesmo soluto, podemos, então, a partir do exposto, determinar a concentração (comum, molaridade) de cada uma das soluções misturadas e também da solução final.
Para tanto, devemos relembrar as fórmulas para calcular essas concentrações:
C = m1
V
-
m1 = massa do soluto da solução
-
V = volume da solução
OBS.: isolando o m1 na fórmula, temos: m1 = C.V
M = m1
M1.V
-
M1 = massa molar do soluto.
OBS.: Isolando o m1 na fórmula, temos: m1 = M.M1.V
Como a mistura de soluções de mesmo soluto aborda a soma da massa do soluto das soluções, podemos substituir cada uma das observações na seguinte expressão:
m1' + m1'' = mF
C'.V' + C''.V'' = CF.VF
-
C' = concentração comum da solução 1
-
C'' = concentração comum da solução 2
Se o cálculo da mistura de soluções envolver a molaridade:
m1' + m1'' = mF
M'.V' + M''.V'' = MF.VF
OBS.: Como o soluto é o mesmo, a massa molar é a mesma em cada uma das soluções; logo, é desprezada no cálculo.
Agora veja exemplos que abordam cálculos em uma mistura de soluções de mesmo soluto sem reação química:
Exemplo 1: (Mackenzie-SP-Adaptada) Adicionando-se 600 mL de uma solução 14g/L de KOH a um certo volume (v) de solução 84 g/L de mesma base, obtém-se uma solução 67,2g/L. O volume (v) adicionado de solução 84 g/L é de:
a) 0100 mL
b) 3000 mL
c) 2700 mL
d) 1500 mL
e) 1900 mL
Os dados fornecidos pelo exercício foram:
V' = 600 mL
C' = 14 g/L
V'' = ?
C'' = 84 g/L
VF = ?
CF = 67,2 g/L
Antes de determinar o volume adicionado da solução 1, devemos inicialmente determinar o volume final por meio da seguinte expressão:
V' + V'' = VF
600 + V'' = VF
Substituindo os valores dados na expressão matemática abaixo, temos:
C'.V' + C''.V'' = CF.VF
14 . 600 + 84.V'' = 67,2.(600 + V'')
8400 + 84.V'' = 67,2 . 600 + 67,2.V''
8400 + 84.V'' = 40320 + 67,2.V''
84.V'' – 67,2.V'' = 40320 – 8400
16,8.V'' = 31920
V'' = 31920
16,8
V'' = 1900 mL
Exemplo 2: (UFOP) Em um balão volumétrico de 1000mL, juntaram-se 250mL de uma solução 2M de ácido sulfúrico com 300mL de uma solução 1M do mesmo ácido e completou-se o volume até 1000mL com água destilada. Determine a molaridade da solução resultante.
Os dados fornecidos pelo exercício foram:
V' = 250 mL
M' = 2 M
V'' = 300 mL
M'' = 1 M
VF = 1000mL
MF = ?
Para determinar a molaridade da solução final, basta utilizar a expressão matemática que representa o processo:
M'.V' + M''.V'' = MF.VF
2 . 250 + 1 . 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0,8 mol/L
Por Me. Diogo Lopes Dias


