No texto “Relação entre polaridade e solubilidade das substâncias”, você viu que geralmente os solutos polares se dissolvem em solventes também polares e que substâncias apolares se dissolvem em solventes também apolares. Entretanto, isso não é uma regra que pode se aplicar a todos os casos de solubilidade.
Por exemplo, o açúcar se dissolve na água, mas o óleo não. É bem verdade que as moléculas de água e de açúcar são polares, enquanto que as do óleo são apolares, porém, são os tipos de forças intermoleculares entre as moléculas dessas substâncias isoladas e entre si que nos fornecem a explicação para esse fato.

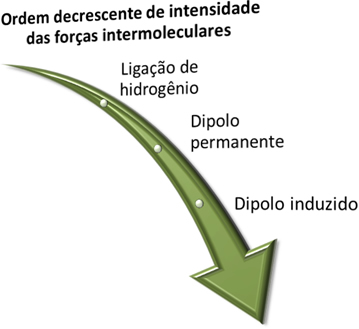
Antes de vermos quais são essas forças, lembre-se de que, em questão de intensidade, a mais forte é a ligação de hidrogênio, que é seguida da força de dipolo permanente e a mais fraca é a força de dipolo induzido.
Tanto as moléculas de água, como as do açúcar (sacarose - C12H22O11), apresentamátomos de oxigênio ligados a átomos de hidrogênio, formando grupos ─ O ─ H. Isso significa que entre as moléculas de água e entre as moléculas de açúcar pode haver as interações intermoleculares de ligações de hidrogênio.
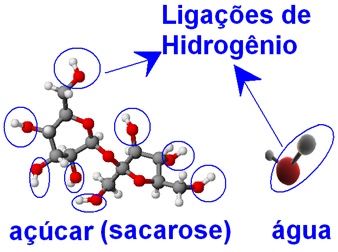
É por isso que as moléculas de água conseguem envolver as moléculas de açúcar que estavam ligadas fortemente em forma de cristais e separá-las, impedindo que voltem a se unir. Desse modo, o açúcar apresenta grande solubilidade em água, sendo que podemos dissolver até 33 g dele em 100 g de água a 20ºC.
Agora, o óleo e a água são imiscíveis. Isso não significa que o óleo não é atraído pela água, pois o fato dele se espalhar sobre a superfície da água, em vez de ficar no formato esférico, nos revela que ele procura um formato no qual uma maior quantidade de moléculas do óleo estejam em contato com as moléculas de água.
No entanto, a atração entre as moléculas de água é muito maior (ligação de hidrogênio) do que a atração entre as moléculas de óleo e água. Por isso, as moléculas de óleo não conseguem romper a ligação entre duas moléculas de água vizinhas.
Isso nos leva a concluir que:
“Se a força intermolecular já existente for mais intensa do que a possível nova interação, então o soluto não solubiliza, permanecendo a ligação original. Mas, se a nova interação for mais forte, o soluto se solubilizará, rompendo as ligações intermoleculares das substâncias.”
Outro exemplo que nos mostra a importância das forças intermoleculares para a solubilidade dos materiais é quando temos o iodo, água e o benzeno. No esquema abaixo, temos que o iodo se dissolve bem no benzeno e é pouco solúvel em água, a água e o benzeno são imiscíveis totalmente e quando temos uma mistura de benzeno e água e depois adicionamos o iodo, ele se dissolve somente no benzeno:
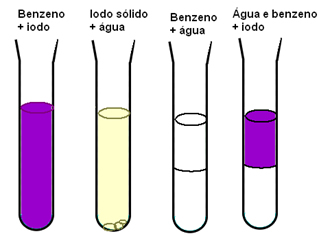
O benzeno e o iodo são apolares, tendo uma maior facilidade para se misturarem do que a água que é polar. Mas, o que nos explica mesmo o que acontece é que as forças intermoleculares de dipolo induzido existentes entre as moléculas apolares são fracas em comparação com as ligações de hidrogênio da água.
Portanto, visto que as interações já existentes entre as moléculas de água são mais fortes do que as possíveis novas interações, as ligações de hidrogênio não são rompidas e observa-se um sistema de duas fases quando misturamos o benzeno e a água.
Já as novas interações que são formadas entre as moléculas do iodo e as moléculas do benzeno são mais intensas do que as que ocorrem entre as moléculas dessas substâncias isoladas.
Por Jennifer Fogaça
Graduada em Química