A titulometria, ou titulação, é um método de análise quantitativa que determina a concentração de uma solução. Dosar uma solução é determinar a sua quantidade por intermédio de outra solução de concentração conhecida.
Essa é uma operação feita em laboratório e pode ser realizada de várias maneiras. A titulação ácido-base é importante para análises em indústrias e é divida em:
- Acidimetria: determinação da concentração de um ácido;
- Alcalimetria: determinação da concentração de uma base;
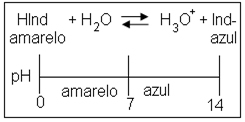
- Indicadores ácido-base: Substâncias que mudam de cor na presença de ácidos ou de bases.
Os indicadores mais usados em laboratórios são:
|
Indicador |
Meio Ácido |
Meio Básico |
| Tornassol | róseo | azul |
| Fenolftaleína | incolor | vermelho |
| Alaranjado de metila | vermelho | amarelo |
| Azul de bromotimol | amarelo | azul |
O papel tornassol vermelho é o indicador que em contato com um ácido torna-se róseo, e com uma base torna-se azul.
O indicador Fenolftaleína: solução que em meio ácido torna-se incolor e em meio básico torna-se vermelha.
Alaranjado de metila é uma solução que no ácido fica vermelha e na base fica amarela.
O azul de bromotimol é uma solução indicadora que em contato com ácido torna-se amarela, e com base torna-se azul.
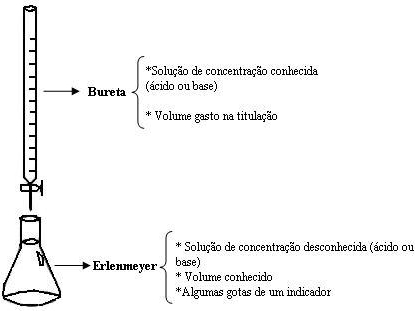
Esquema da Titulação
Os equipamentos usados habitualmente em uma titulação são uma bureta e um erlenmeyer, representados na figura a seguir:
Ao abrir a torneira da bureta, começará a reação entre o ácido e a base. A titulação termina quando é evidenciada a mudança de cor da solução do erlenmeyer.
A coloração obtida indica se o meio é ácido ou básico, o que depende do tipo de indicador utilizado (observe no quadro de indicadores acima mencionado).
Por Líria Alves
Graduada em Química