Digamos que temos três colheres. Na primeira, colocamos 5 gotas de água; na segunda, colocamos 5 gotas de álcool e na terceira, 5 gotas de acetona. Depois de esperarmos um tempo, veremos que rapidamente a acetona irá passar para o estado gasoso, seguida do álcool e só depois de muito tempo é que a água irá evaporar.
Esse exemplo nos mostra que as substâncias não passam para o estado gasoso ou para o estado de vapor ao mesmo tempo e, consequentemente, os seus pontos de ebulição são também diferentes.
Para entendermos porque isso ocorre, precisamos entender primeiro quando ocorre essa passagem do estado líquido para o gasoso (ou para vapor, no caso da água). As moléculas dos líquidos num recipiente estão constantemente sob agitação, pois elas possuem certa liberdade para se movimentarem. A pressão atmosférica exerce uma força sobre essas moléculas que as impede de passarem para o estado gasoso. Além disso, as moléculas realizam ligações intermoleculares entre si, que também dificultam a mudança de estado físico.
No entanto, quando essas moléculas adquirem uma energia cinética determinada, elas conseguem romper as suas ligações intermoleculares e a inércia, havendo a mudança para o estado gasoso ou de vapor.
Quando aumentamos a temperatura desse líquido, estamos fornecendo energia ao sistema, o que faz com que essas moléculas adquiram mais rapidamente a energia necessária para mudarem de estado, o que acontece quando atingem o seu ponto de ebulição.
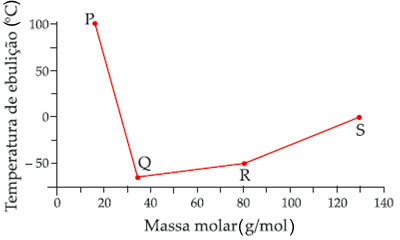
No caso do exemplo dado, os pontos de ebulição da acetona, do álcool e da água são, respectivamente, 56,2 ºC, 78,5 ºC e 100 ºC, ao nível do mar. Isso explica a ordem da evaporação mencionada para esses líquidos.
Mas, por que essa diferença?
Existem dois fatores básicos que justificam as diferenças dos pontos de ebulição das substâncias, que são: interações intermoleculares e massas molares.
Vamos analisar a lista a seguir para ver como esses fatores influenciam o ponto de ebulição das substâncias:
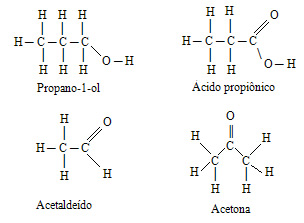
- Interações intermoleculares:

Se a interação intermolecular for intensa, será necessário fornecer ainda mais energia ao sistema para que ela se rompa e a molécula consiga passar para o estado gasoso.
A intensidade dessas interações entre as moléculas segue a seguinte ordem decrescente:
Ligações de hidrogênio > dipolo permanente > dipolo induzido
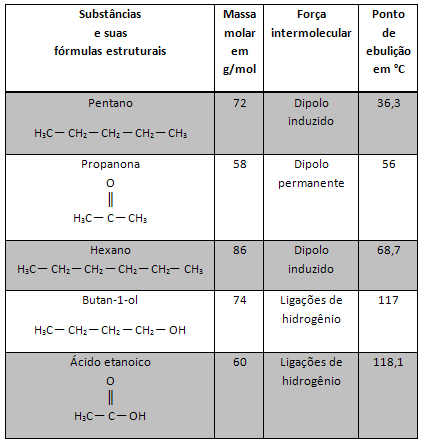
Por exemplo, na tabela, vemos que os pontos de ebulição do butan-1-ol e do ácido etanoico são maiores que os das outras substâncias. Isso ocorre porque essas duas substâncias possuem ligações de hidrogênio, que são interações mais intensas que as demais.
Além disso, o ponto de ebulição da propanona é maior que a do pentano, porque a interação da propanona é dipolo permanente, que é mais intensa do que a de dipolo induzido, que é a interação realizada pelo pentano.
Mas, por que o ponto de ebulição da propanona não é maior que o do hexano, visto que ele também realiza a interação dipolo induzido?
É aí que entra o segundo fator que interfere no ponto de ebulição de uma substância: a massa molar.
- Massas Molares:

Se a massa da molécula for grande, será necessário fornecer mais energia ao sistema para que a molécula consiga vencer a inércia e passar para o estado gasoso.
Por exemplo, o pentano e o hexano realizam a mesma interação, que é a de dipolo induzido, mas a massa molar do hexano é maior. Por isso, o ponto de ebulição do hexano é maior que o do pentano.
No caso do butan-1ol e do ácido etanoico, ambos realizam ligações de hidrogênio e o butan-1-ol possui massa molar maior. No entanto, o ponto de ebulição do ácido etanoico é maior, porque duas moléculas de ácido etanoico podem estabelecer entre si duas ligações de hidrogênio (por meio dos grupos O e OH), enquanto duas moléculas de butan-1-ol estabelecem apenas uma ligação de hidrogênio entre si (por meio do grupo OH).
Por Jennifer Fogaça
Graduada em Química