Temos uma mistura de soluções com solutos diferentes sem reação química quando duas ou mais misturas que apresentam substâncias com um mesmo íon em comum (seja o mesmo cátion ou mesmo ânion). Como no exemplo abaixo:
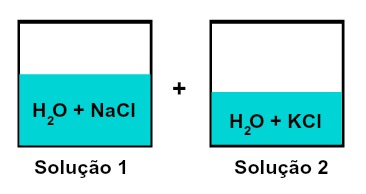
Mistura de soluções que possuem solutos diferentes
A solução 1 é formada por água e cloreto de sódio (NaCl), enquanto a solução 2 possui água e cloreto de potássio (KCl). Quando misturadas temos uma mistura de soluções de solutos diferentes sem reação química, porque ambos sais utilizados possuem o ânion cloreto (Cl-).
1- Características das misturas de soluções de solutos diferentes sem reação química
Quando uma mistura de soluções que apresentam solutos diferentes sem reação química é realizada, as características abaixo são sempre verificadas:
-
A massa de cada um dos solutos não modifica (se na solução 1 tivermos 10 g de soluto e na 2, 30 g, por exemplo, após a mistura teremos a mesma massa de cada soluto),
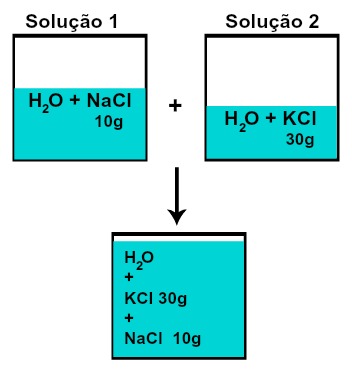
Massa de cada um dos solutos após a mistura de soluções sem reação química
-
A quantidade de matéria (n) de cada um dos solutos não modifica (se na solução 1 tivermos 5 mol de soluto e na 2, 4 mol, por exemplo, após a mistura teremos a mesma quantidade de matéria de cada),
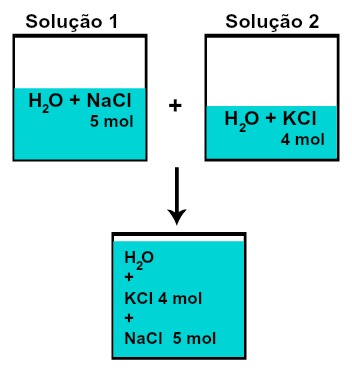
Número de mol de cada um dos solutos após a mistura de soluções sem reação química
-
O volume da solução final, VF, é o resultado da soma dos volumes de cada uma das soluções misturadas (se na solução 1 tivermos 200 mL e na 2, 300 mL, por exemplo, após a mistura teremos 500 mL de volume),
VF = V1 + V2
2- Fórmulas utilizadas nos cálculos de mistura de soluções de solutos diferentes sem reação química.
Como neste tipo de mistura temos apenas o aumento da quantidade de solvente em relação a cada um dos solutos, devemos calcular a concentração final de cada um dos solutos utilizando as seguintes expressões:
a) Para concentração comum (C)
Para a solução 1: a multiplicação da concentração da solução 1 pelo seu volume é igual à concentração final multiplicada pelo seu volume
C1.V1 = CF.VF
Para a solução 2: a multiplicação da concentração da solução 2 pelo seu volume é igual à concentração final multiplicada pelo seu volume
C2.V2 = CF.VF
b) Para concentração em quantidade de matéria ou molaridade (M)
Para a solução 1:
M1.V1 = MF.VF
Para a solução 2:
M2.V2 = MF.VF
c) Concentração em quantidade de matéria de cada íon presente na solução
Caso tenhamos que determinar a concentração de um ou de todos os íons presentes na solução final, devemos:
-
1º: Lembrar que a concentração do íon é dada pela multiplicação da concentração (M), do soluto de onde ele provém, pelo seu índice na fórmula da substância. Assim, para o íon Y, na substância 1, XY3, a concentração será:
[Y]1 = 3. M
Já para o soluto2, ZY, a concentração de Y seria dada por:
[Y]2 = 1. M
-
2º: Caso tenhamos mais de um soluto que libere um mesmo íon, por exemplo, os solutos XY3 e ZY, os quais apresentam o mesmo íon Y, a concentração deste íon na solução final é dada pela soma das concentrações dele referente a cada soluto:
[Y]F = [Y]1 + [Y]2
3- Exemplos de cálculos envolvendo mistura de soluções de solutos diferentes sem reação química
Exemplo 1: (PUC SP) Em um béquer foram misturados 200 mL de uma solução aquosa de cloreto de cálcio (CaCl2) de concentração 0,5 mol.L–1 e 300 mL de uma solução 0,8 mol.L–1 de cloreto de sódio (NaCl). A solução obtida apresenta concentração de ânion cloreto de aproximadamente:
a) 0,34 mol.L–1
b) 0,65 mol.L–1
c) 0,68 mol.L–1
d) 0,88 mol.L–1
e) 1,3 mol.L–1
Os dados fornecidos pelo exercício foram:
-
Solução 1:
Volume (V1): 200 mL
Concentração molar (M1): 0,5 mol.L–1
-
Solução 2:
Não pare agora... Tem mais depois da publicidade ;)
Volume (V2): 300 mL
Concentração molar (M2): 0,8 mol.L–1
Para determinar a concentração de ânions cloreto (Cl-), devemos seguir os seguintes passos:
Passo 1: calcular o volume da solução final
VF = V1 + V2
VF = 200 + 300
VF = 500 mL
Passo 2: Calcular a concentração molar da solução final com relação ao soluto CaCl2, utilizando a expressão abaixo:
M1.V1 = MF.VF
0,5.200 = MF.500
100 = MF.500
100 = MF
500
MF = 0,2 mol.L–1
Passo 3: Calcular a concentração molar de cloreto[Cl-]1, na solução final, proveniente do soluto CaCl2, utilizando a expressão abaixo:
OBS.: Na fórmula temos a multiplicação da molaridade por 2 pelo fato de termos índice 2 no Cl, na fórmula do soluto CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol.L–1
Passo 4: Calcular a concentração molar da solução final com relação ao soluto NaCl, utilizando a expressão abaixo:
M2.V2 = MF.VF
0,8.300 = MF.500
240 = MF.500
240 = MF
500
MF = 0,48 mol.L–1
Passo 5: Calcular a concentração molar de cloreto, [Cl-]2, na solução final, proveniente do soluto NaCl, utilizando a expressão abaixo:
OBS.: Na fórmula temos a multiplicação da molaridade por 1 pelo fato de termos índice 1 no Cl, na fórmula do soluto NaCl.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol.L–1
Passo 6: Calcular a quantidade total de íons cloreto na solução final
Para isso, basta somar as concentrações molares de cloretos referentes a cada um dos solutos nos passos 3 e 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol.L–1
Exemplo 2: A uma solução de 500 mL de KOH 6 mol/L foi adicionado 300 mL de solução de K2SO3 3 mol/L. Qual a concentração de de cada um dos solutos na mistura resultante
a) 3,75 e 3,0 mol/L
b) 3,75 e 1,215 mol/L
c) 4,5 e 1,125 mol/L
d) 3,75 e 1,125 mol/L
e) 4,5 e 1,215 mol/L
Os dados fornecidos pelo exercício foram:
-
Solução 1:
Não pare agora... Tem mais depois da publicidade ;)
Volume (V1): 500 mL
Concentração molar (M1): 6 mol.L–1
-
Solução 2:
Volume (V2): 300 mL
Concentração molar (M2): 3 mol.L–1
Para determinar a concentração de ânions cloreto (Cl-), devemos seguir os seguintes passos:
Passo 1: calcular o volume da solução final
VF = V1 + V2
VF = 500 + 300
VF = 800 mL
Passo 2: Calcular a concentração molar da solução final com relação ao soluto KOH, utilizando a expressão abaixo:
M1.V1 = MF.VF
6.500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3,75 mol.L–1
Passo 3: Calcular a concentração molar da solução final com ralação ao soluto K2SO3, utilizando a expressão abaixo:
M2.V2 = MF.VF
3.300 = MF.800
900 = MF.800
900 = MF
800
MF = 1,125 mol.L–1
Por Me. Diogo Lopes Dias