A Química estuda a matéria e as transformações sofridas por ela. A matéria, por sua vez, é tudo aquilo que ocupa lugar no espaço e que, portanto, possui massa e volume. Ela pode ser encontrada de duas formas básicas: substâncias e misturas.
Conforme explicado no texto “O que é uma substância?”, uma substância configura-se quando determinado material é formado somente por um tipo de componente (que pode ser partículas como átomos, moléculas, fórmulas unitárias, elétrons ou íons) e, como resultado, apresenta propriedades físicas, como ponto de fusão, ponto de ebulição e densidade, fixas e bem definidas.
Já as misturas são sistemas formados por duas ou mais substâncias compostas ou simples que sejam diferentes. Dessa forma, apresentam as propriedades físicas não definidas e variáveis. Essas propriedades dependem da quantidade de cada substância na mistura e da natureza delas.
Tópicos deste artigo
Mapa Mental: Misturas
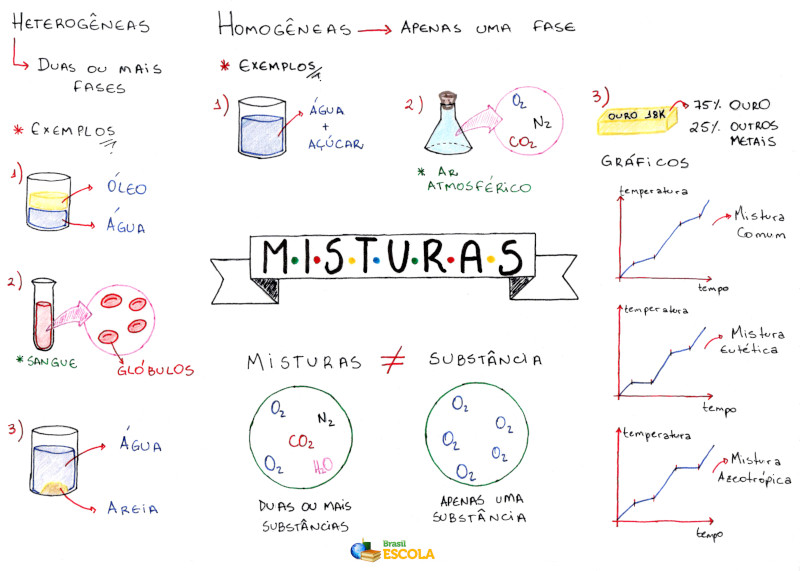
*Baixe o mapa mental sobre misturas!
Por exemplo, o álcool etílico comum que usamos para limpeza e desinfecção não é uma substância pura, pois ele não é constituído somente por moléculas de etanol (H3C-CH2-OH). Conforme o próprio rótulo no frasco desse produto indica, ele é uma mistura de etanol e água (H2O). Por exemplo, se você ver no rótulo que o álcool possui uma concentração de 96ºGL (graus Gay-Lussac), isso significa que, em 100 partes dessa mistura, há 96 partes de etanol e 4 partes de água, ou seja, um frasco de 100 mL de álcool hidratado possui 96 mL de etanol e 4 mL de água.
As misturas podem ser classificadas em homogêneas e heterogêneas. No caso do álcool hidratado, temos uma mistura homogênea. Mas o que é uma mistura homogênea? É uma mistura em que não conseguimos ver a separação dos seus componentes. Toda a sua extensão é unifome e apresenta uma única fase.
Essas misturas homogêneas são também chamadas de soluções, possuindo as partículas dispersas com o diâmetro menor que 1 nm, ou seja, nem mesmo com um ultramicroscópio é possível ver mais de uma fase nesses materiais. Além disso, os seus componentes não podem ser separados por métodos físicos, como por centrífugas ou por filtração.
O sangue é uma mistura. A olho nu, parece que ele é uma mistura homogênea, mas não é, pois, no microscópico, vemos seus componentes. Além disso, ao colocá-lo em uma centrífuga, esses constituintes são separados.
.jpg)
Sangue centrifugado e sua imagem no microscópio
As misturas homogêneas ou soluções podem apresentar-se nos três estados físicos. O álcool hidratado mencionado é um exemplo de mistura líquida. O ar é uma mistura gasosa composta de vários gases, sendo que os principais são o nitrogênio (N2) e o oxigênio (O2). As ligas metálicas são misturas sólidas, como o aço que é composto por aproximadamente 98,5% de Fe (ferro), 0,5 a 1,7% de C (carbono) e traços de Si (silício), S (enxofre) e P (fósforo).
As misturas heterogêneas, por outro lado, são aquelas que possuem mais de uma fase, como a mistura de água e óleo, água e areia, granito (mistura de quartzo, mica e feldspato) e assim por diante.

Exemplo de mistura heterogênea trifásica
Conforme mencionado, as propriedades físicas das misturas não são constantes nem determinadas. Porém, existem certas misturas que são excessões, as misturas azeotrópicas e eutéticas. As misturas azeotrópicas possuem ponto de ebulição ou de condensação constante, comportando-se, nesse ponto, como uma substância pura. O álcool a 96% mencionado é uma mistura azeotrópica porque possui ponto de ebulição constante em 78,2°C.
Agoras, as misturas eutéticas são aquelas que se comportam como se fossem uma substância pura somente durante o ponto de solidificação ou fusão. Um exemplo é a liga metálica feita de 40% de cádmio e 60% de bismuto, que possui ponto de fusão constante igual a 140°C.
Mas a grande maioria das misturas muda de estado físico não em uma temperatura fixa, mas em faixas de temperaturas não específicas.
Mapa mental Por M.e Victor Ricardo Ferreira
Professor de Química
Por Jennifer Fogaça
Graduada em Química

