Quando se misturam duas soluções, sejam elas diferentes ou não, é necessário analisar primeiramente se ocorre reação ou não entre elas. Por exemplo, se misturarmos uma solução de água com açúcar (solução aquosa de sacarose) com uma solução de água com sal (salmoura), obteremos uma mistura de soluções sem reações químicas.
O mesmo ocorre se misturarmos duas soluções de cloreto de sódio (NaCl), com concentrações diferentes. Nesse caso também não ocorrerá reação. Podemos, então, definir esse exemplo como uma mistura de soluções de mesmo soluto, sem ocorrência de reação química, em que o primeiro exemplo é uma mistura de soluções de solutos diferentes, sem ocorrência de reação química.
Em ambos os casos, a constituição química dos componentes das soluções não mudará, no entanto, alguns aspectos quantitativos terão que ser recalculados.
Para entender como poderíamos determinar a concentração molar (Molaridade) e a concentração comum de uma mistura de soluções sem ocorrência de reação, vejamos a resolução dos dois casos citados:
1º) Mistura de soluções de mesmo soluto, sem ocorrência de reação química:

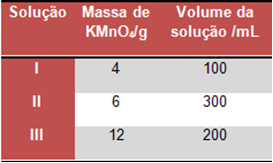
Imagine que misturamos duas soluções de cloreto de sódio, uma com a concentração de 2,0 g/L em 60,0 mL de solução e a outra com 2,5 g/L em 80 mL de volume de solução.
Visto que não ocorre reação nenhuma, tanto a massa quanto o volume são apenas a soma das massas e volumes iniciais:
m (solução) = m1 (NaCl) + m2 (NaCl)
m1 (NaCl) = v . C m2 (NaCl) = v . C
m1 (NaCl) = 0,06L . 2,0g/L m2 (NaCl) = 0,08L . 2,5 g/L
m1 (NaCl) =0,1 g m2 (NaCl) =0,2 g
m (solução) = 0,1 g + 0,2 g
m (solução) =0,3 g
v (solução) = v1 (NaCl) + v2 (NaCl)
v (solução) = (60 + 80) mL
v (solução) =140 mL = 0,14 L
A concentração pode então ser obtida por meio desses dados:
C (solução) = m(solução)
v(solução)
C (solução) = 0,3 g
0,14L
C (solução) ≈ 2,14 g/L
2º) Mistura de soluções de solutos diferentes, sem ocorrência de reação química:
Tomemos por exemplo a mistura entre 500 mL de uma solução aquosa de sacarose (C12H22O11) que tinha inicialmente a concentração de 18,0 g/L, com 1 L da solução de água com sal (solução aquosa de cloreto de sódio – NaCl) com 100,0 g/L de concentração.
Depois da mistura, qual passou a ser a molaridade, a concentração comum, a massa e o volume da solução resultante da mistura?
Visto que não houve reação química, as massas de C12H22O11 e NaCl permanecem inalteradas. E os valores das massas iniciais podem ser conseguidos por meio de regra de três simples usando as concentrações das reações.
18,0 g ------ 1 L
m (C12H22O11) ----0,5L
m (C12H22O11) = 9,0 g
m (NaCl)-----100,0 g
A massa também pode ser conseguida pela fórmula:
m = v . C
m (C12H22O11) = 0,5 L . 18g/L
m (C12H22O11) = 9,0 g
m (NaCl) = 1 L . 100,0 g/L
m (NaCl) = 100,0 g
Assim, a massa total da solução é a soma das duas massas:
m (solução) = m (C12H22O11) + m (NaCl)
m (solução) = 109,0 g
O volume é simplesmente a soma dos volumes iniciais, assim temos:
v (solução final) = v (C12H22O11) + v (NaCl)
v (solução final) = (0,5 + 1)L
v (solução final) = 1,5L
A concentração final é conseguida calculando-se separadamente as concentrações de cada um dos solutos. Visto que eles não reagem entre si e suas massas não mudam, podemos usar a seguinte fórmula da concentração:
C = m
v
Cinicial = minicial Cfinal = mfinal
vinicial vfinal
minicial = mfinal
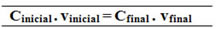
C (C12H22O11) =?
Cinicial . vinicial = Cfinal . vfinal
18,0 g/L . 0,5 L = Cfinal .1,5 L
C (C12H22O11) final = 6,0 g/L
C (NaCl)=?
Cinicial . vinicial = Cfinal . vfinal
100,0 g/L . 1 L = Cfinal .1,5 L
C (NaCl)final = 66,67 g/L
A relação feita para essa fórmula da concentração comum pode ser feita também para calcular a molaridade (Mi . vi = Mf . vf) e para a concentração em massa por massa (Título - Ti . vi = Tf . vf).
Por Jennifer Fogaça
Graduada em Química