O hélio, símbolo He e número atômico 2, é o primeiro gás nobre da Tabela Periódica. Entre suas principais características está sua baixa densidade e seu baixíssimo ponto de ebulição, o menor entre os elementos. Seu estado sólido é de difícil obtenção, exigindo altíssimas pressões. Possui apenas dois isótopos estáveis e é reconhecido por sua grande inércia química e caráter não inflamável.
Trata-se do segundo elemento mais abundante do universo, mas está pouco presente na atmosfera terrestre. Pode ser obtido por liquefação fracionada de misturas gasosas e é empregado principalmente em atividades criogênicas, como fluido refrigerador. Também se aproveita sua baixa densidade para inflar balões meteorológicos, pneus de grandes aeronaves e balões de festas.
Leia também: Bismuto — um dos poucos materiais que se expandem ao solidificar-se
Tópicos deste artigo
- 1 - Resumo sobre o hélio
- 2 - Propriedades do hélio
- 3 - Características do hélio
- 4 - Para que serve o hélio?
- 5 - Onde o gás hélio é encontrado?
- 6 - Obtenção do gás hélio
- 7 - Por que o gás hélio afina a voz?
- 8 - História do hélio
Resumo sobre o hélio
-
O hélio é o primeiro gás nobre presente na Tabela Periódica, com número atômico igual a 2.
-
É o elemento com menor ponto de ebulição, além de ter uma densidade muito pequena.
-
É reconhecido por sua inércia química e, assim, não é um gás inflamável.
-
É o segundo elemento mais presente no universo, mas é pouco presente na atmosfera terrestre.
Não pare agora... Tem mais depois da publicidade ;) -
Pode ser obtido via liquefação fracionada.
-
É empregado em atividades criogênicas como fluido refrigerante.
-
Sua baixa densidade faz com que seja utilizado para inflar pneus e balões.
-
Foi descoberto em 1868 pelos astrônomos Jules Janssen e Norman Lockyer.
Propriedades do hélio
-
Símbolo: He.
-
Massa atômica: 4,002602(2).
Não pare agora... Tem mais depois da publicidade ;) -
Número atômico: 2.
-
Ponto de ebulição: -268,93 °C.
-
Ponto de fusão: -272 °C (a 26 atm).
-
Densidade: 0,1785 g.L-1 (0 °C e 1 atm), 0,125 g.mL-1 (no ponto de ebulição).
-
Configuração eletrônica: 1s2.
-
Série química: gases nobres, grupo 18.
Não pare agora... Tem mais depois da publicidade ;)
Características do hélio
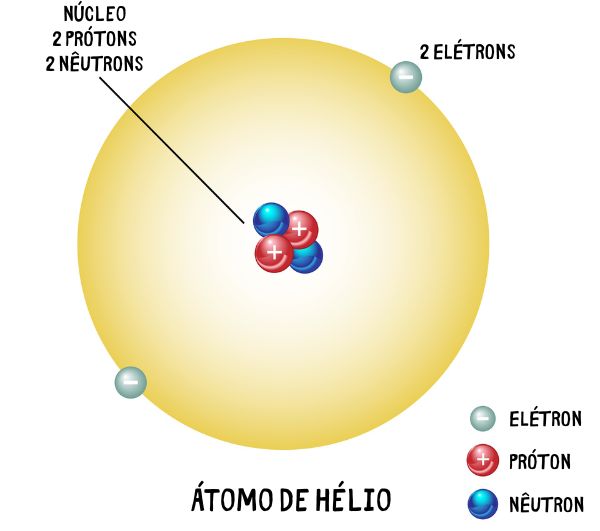
O elemento de número atômico 2 da Tabela Periódica é conhecido pela sua relativa inércia, e, por causa dessa característica, não existem substâncias compostas estáveis de He. Além disso, ele existe na natureza na forma de um gás monoatômico, diferentemente de boa parte dos gases mais abundantes do planeta, que estão na forma diatômica. Possui apenas dois isótopos estáveis conhecidos: 3He e 4He.
Não só por conta de sua inércia química, mas também pelo fato de seu ponto de ebulição ser muito baixo, poucas unidades acima do zero absoluto (0 K), é comum se referir ao hélio como gás hélio. Aliás, o hélio é um elemento que dificilmente se solidifica, sendo necessárias altíssimas condições de pressão (cerca de 26 vezes maior que a pressão atmosférica ao nível do mar) para solidificá-lo, e em baixíssimas temperaturas.
Em sua forma gasosa, o He é capaz de se difundir através da borracha e boa parte dos vidros. Já em sua forma líquida, apresenta uma condutividade térmica 600 vezes maior que a do cobre, com viscosidade próxima de zero. O hélio líquido consegue formar filmes com espessura na faixa de poucos átomos.
Para que serve o hélio?
A maior utilidade do gás hélio se dá em sistemas criogênicos. Sua baixa temperatura de liquefação é utilizada por cientistas para atingir temperaturas muito próximas ao zero Kelvin (-273,15 °C). É nessa faixa de temperatura que se alcança a condição de supercondutividade, estado em que os materiais não apresentam mais resistência elétrica.
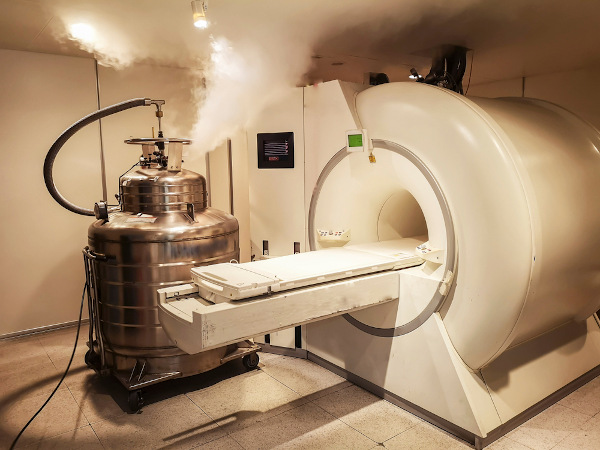
Uma aplicação de grande impacto do hélio líquido e também dos supercondutores está na obtenção de imagens em exames de ressonância magnética. Nestes, um material supercondutor está imerso em hélio líquido, a fim de gerar um campo eletromagnético intenso para a obtenção da imagem resultante.
O hélio é também empregado para a criação de atmosfera inerte, já que o elemento dificilmente vai reagir. Essa inércia se aplica na solda de alguns metais, de modo a impedir que, quando fundidos, eles consigam reagir com o oxigênio e o nitrogênio presentes na atmosfera. Para mergulhadores que frequentam altas pressões, é comum a utilização de cilindros O2/He, em vez de O2/N2, já que o hélio é menos solúvel no sangue e também não causa a doença da descompressão, que é causada quando o nitrogênio dissolvido em altas pressões no sangue forma bolhas quando a pressão diminui.
Sendo muito leve e não inflamável, o He é empregado para inflar pneus de grandes aeronaves, assim como balões de festa e balões meteorológicos.
Leia também: Criptônio (Kr) — outro elemento pertencente ao grupo dos gases nobres
Onde o gás hélio é encontrado?
O hélio é o segundo elemento mais abundante do universo, ficando apenas atrás do hidrogênio. Porém, como o mesmo não é segurado pela força gravitacional do planeta Terra, apenas cerca de 0,0005% do volume de nossa atmosfera é composta por He. Em outros planetas, como Urano, o hélio representa 15% do volume da atmosfera, algo mais próximo do seu teor em nossa galáxia.
Esse elemento pode ser encontrado em depósitos de gás natural, em uma proporção de cerca de 7% em volume, provavelmente por conta do decaimento radioativo de elementos mais pesados (a partícula alfa é um núcleo de He). Por conta disso, o hélio é também encontrado em minerais que possuem isótopos instáveis emissores de partículas alfa.
Grandes amostras de hélio podem ser encontradas nos seguintes países:
-
Não pare agora... Tem mais depois da publicidade ;)
Obtenção do gás hélio
O gás hélio pode ser obtido de cargas de gás natural via liquefação fracionada, já que possui o menor ponto de ebulição de todos. O gás hélio remanescente é retirado via bombeamento.
Por que o gás hélio afina a voz?
O hélio, em sua forma gasosa, é cerca de sete vezes menos denso que o ar. Ao ingerirmos o gás hélio, nossa cavidade vocal fica repleta desse gás, e, nesse caso, por ser mais leve, o som de nossa voz se propaga em uma velocidade maior. A velocidade de propagação do som é diretamente proporcional à frequência das ondas sonoras e, consequentemente, quanto maior a frequência, mais agudo é o som.
Da mesma forma, se inalarmos um gás mais denso que o ar, nossa voz terá uma frequência menor e, como consequência, teremos um som mais grave na voz.
Embora a prática seja considerada inofensiva, não se deve inalar volumes consideráveis, já que pode causar asfixia por ausência de oxigênio e tontura. Em condições extremas, como qualquer gás, o hélio pode formar bolhas em nosso cérebro e causar até mesmo um AVC e morte.
História do hélio
O elemento químico de número 2 da Tabela Periódica tem sua descoberta creditada a dois cientistas: o astrônomo francês Pierre Janssen e o astrônomo inglês Norman Lockyer — o primeiro editor da célebre revista científica Nature.
Janssen viajou para o leste da Índia durante a primavera de 1868 buscando observar um eclipse solar utilizando um espectroscópio, um instrumento inédito para aquela época. A ideia do francês era fazer novas descobertas acerca da composição química do Sol. O espectroscópio, inventado pelo alemão Gustav Kirchhoff, era o principal instrumento para identificar novos elementos àquela altura e acabou motivando diversos cientistas, como Janssen, a utilizá-lo para tal fim.
Dito e feito: no dia do eclipse solar, o astrônomo francês observou um padrão de linhas espectrais até então inédito, de coloração amarela. No dia 20 de outubro do mesmo ano, na Universidade de Cambridge, sem saber dos trabalhos de Janssen, o astrônomo inglês Norman Lockyer observou o mesmo padrão de linhas espectrais inédito. Lockyer, entretanto, decidiu batizar o novo elemento de hélio, em alusão à palavra grega para designar o Sol, helios.
Coincidentemente, as descobertas de ambos os astrônomos chegaram ao mesmo dia na Academia Francesa de Ciências, em Paris, que dividiu o crédito da descoberta entre os dois. Mesmo assim, muitos cientistas duvidaram do trabalho de Janssen e Lockyer, com intensas e duras críticas, as quais apenas aumentaram conforme o novo elemento não era detectado no planeta Terra.
Entre os opositores do trabalho dos astrônomos estava ninguém mais ninguém menos que Dmitri Mendeleev, o criador da Tabela Periódica. Mesmo com as descobertas de elementos que tomaram conta dos espaços vazios propostos pelo químico russo, nenhuma delas ajudava no caso do hélio, visto que não havia, até então, espaço previsto para o novo elemento na Tabela Periódica.
O verdadeiro reconhecimento para Janssen e Lockyer só se iniciou em 1894. Naquele ano, o químico inglês William Ramsay descobriu o argônio, um gás inerte. Depois, em 1895, isolou um elemento quimicamente semelhante ao argônio, por meio de um minério de urânio, com o mesmo padrão de linhas espectrais observado pelos astrônomos. Assim, pode-se concluir que Ramsay encontrou hélio na Terra. O cientista inglês ainda descobriu outros gases nobres, como criptônio, neônio e xenônio, não previstos por Mendeleev na primeira versão de sua Tabela Periódica. Por seus estudos, em 1904, William Ramsay foi agraciado com o Prêmio Nobel de Química.
Por Stéfano Araújo Novais
Professor de Química


