Átomo é a partícula que constitui a matéria, ou seja, é tudo aquilo que possui massa e volume. É dividido basicamente em duas regiões: o núcleo, de caráter positivo, e a eletrosfera, de caráter negativo. Apesar de vir do grego, “indivisível”, o átomo é dividido em partículas menores, conhecidas como partículas subatômicas.
O átomo, apesar de não ser perceptível a olho nu ou com os melhores instrumentos ópticos, pode ser estudado e compreendido por meio de modelos, os quais foram se desenvolvendo conjuntamente com a ciência. O átomo teve origem na Grécia Antiga, por meio dos filósofos Leucipo e Demócrito, tendo sido, inicialmente, uma ideia.
Leia também: Quais são os estados físicos da matéria?
Tópicos deste artigo
- 1 - Resumo sobre átomo
- 2 - Videoaula sobre átomo
- 3 - Estrutura do átomo
- 4 - Quais são as propriedades do átomo?
- 5 - Composição do átomo
- 6 - Semelhança atômica
- 7 - Modelos atômicos
- 8 - História do átomo
- 9 - Curiosidades sobre o átomo
- 10 - Exercícios resolvidos sobre átomo
Resumo sobre átomo
- Os átomos são os constituintes da matéria, sendo divididos em duas regiões: o núcleo e a eletrosfera.
- O núcleo atômico tem caráter positivo, pois é composto de prótons e nêutrons, além de ser extremamente denso.
- A eletrosfera é a região periférica do átomo, na qual estão os elétrons, de caráter negativo.
- Os átomos são eletricamente neutros e identificados pelo seu número de prótons, conhecido como número atômico.
- Os elétrons possuem massa desprezível, por isso, a massa do átomo só depende dos seus prótons e nêutrons.
- Os átomos são compreendidos e estudados com base em modelos atômicos, os quais evoluíram de acordo com a ciência e a tecnologia.
- Inicialmente o átomo foi concebido como uma ideia pelos filósofos gregos Leucipo e Demócrito.
Videoaula sobre átomo
Estrutura do átomo
O átomo, basicamente, é dividido em duas regiões: o núcleo atômico e a eletrosfera. O núcleo atômico é caracterizado pela sua grande densidade: concentra quase a totalidade da massa atômica em um pequeno volume. É nessa parte que estão localizados os prótons, de carga positiva, e os nêutrons, os quais possuem carga neutra.
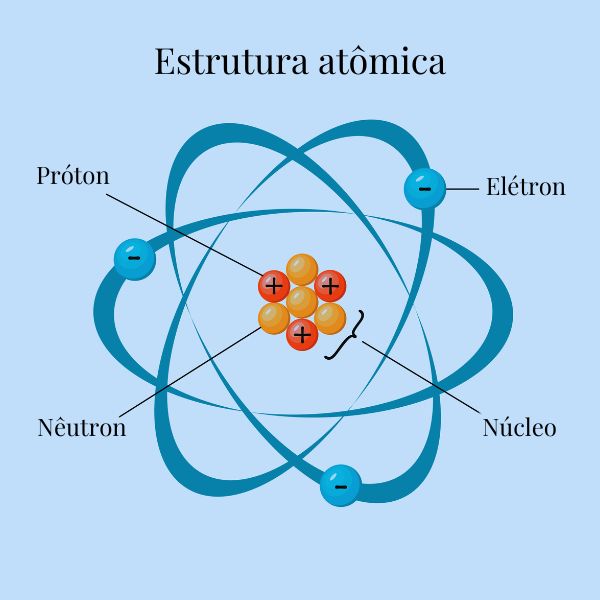
Na eletrosfera, região periférica ao núcleo, estão localizados os elétrons, os quais possuem carga elétrica negativa e cuja massa é insignificante em comparação aos prótons e nêutrons.
Para se ter uma noção da dimensão do átomo, podemos imaginá-lo como um estádio de futebol. O núcleo atômico seria equivalente a uma bola de futebol localizada no centro do campo, enquanto o restante seria a eletrosfera.
Quais são as propriedades do átomo?
Os átomos possuem três propriedades básicas, as quais são fundamentais para seu reconhecimento e compreensão.
1. Todo átomo é identificado pelo seu número atômico.
Para se identificar à qual elemento químico determinado átomo pertence, deve-se avaliar o seu número atômico, comumente representado pela letra Z. O número atômico é numericamente igual ao número de prótons.
2. Os elétrons possuem massa desprezível em comparação aos prótons e nêutrons.
A rigor, as três partículas fundamentais da estrutura atômico deveriam ser responsáveis pela massa atômica (ou número de massa), comumente representada pela letra A. Ocorre que os elétrons possuem uma massa cerca de 1836 vezes menor que os prótons e os nêutrons, o que torna a sua contribuição irrelevante. Assim sendo, considera-se que a massa do átomo só depende do número de prótons e nêutrons; logo:
A = p + n ou A = Z + n
3. Todo átomo é eletricamente neutro.
Os átomos são espécies de caráter eletricamente neutro, o que quer dizer que, para cada carga positiva, deve haver uma carga negativa. Por isso, em um átomo, o número de prótons é sempre igual ao número de elétrons.
Um questionamento comum a se fazer é: se o número de prótons é igual ao número de elétrons e o número de prótons é numericamente igual ao número atômico, por que não se define o número atômico como número de elétrons?
A resposta para tal pergunta reside no fato de que o número de elétrons em uma espécie atômica acaba variando com facilidade em diversos processos químicos, ou seja, é comum que um átomo ganhe ou perca elétrons em uma reação química, por exemplo, sem mudar significativamente a sua natureza.
Veja também: Tabela Periódica — organização dos elementos químicos em ordem crescente de número atômico
Composição do átomo
Como explicado anteriormente, os átomos são comumente apresentados como estruturas compostas por três partículas fundamentais subatômicas:
- prótons, de caráter positivo;
- nêutrons, de caráter elétrico neutro;
- elétrons, de caráter negativo.
Contudo, já é sabido que outras partículas subatômicas estão presentes, como: os quarks, os pósitrons, os neutrinos, os píons, os mésons, os múons, entre outros.
Os prótons e nêutrons são partículas subatômicas compostas, já que são formadas por outras partículas. Os prótons, por exemplo, são compostos por dois quarks up e um quark down. Já os nêutrons são compostos por um quark up e dois quarks down. Os elétrons são conhecidos como partículas subatômicas fundamentais, pois não são formados por outras partículas.
Semelhança atômica
Átomos diferentes podem possuir semelhanças, sendo eles do mesmo elemento químico ou não. Esse fenômeno tem a ver com semelhanças nos números de prótons, elétrons e nêutrons entre espécies atômicas diferentes.
- Isótopos: são espécies atômicas diferentes, mas que possuem o mesmo número de prótons.
- Isótonos: são espécies atômicas diferentes, mas que possuem o mesmo número de nêutrons.
- Isóbaros: são espécies atômicas diferentes, mas que possuem o mesmo número de massa.
- Isoeletrônicos: são espécies atômicas diferentes, mas que possuem o mesmo número de elétrons.
Modelos atômicos
Os átomos são estruturas que não podem ser vistas nem pelos melhores dos instrumentos ópticos disponíveis. Assim sendo, a compreensão da sua estrutura e das suas propriedades ocorreu por diversos experimentos, os quais foram dando pistas sobre como é a natureza do átomo.
Conforme a tecnologia foi avançando e avanços na ciência foram sendo alcançados, a forma de se entender o átomo também foi caminhando progressivamente. Para fins didáticos, os cientistas foram definindo, ao longo da história, modelos atômicos, ou seja, formas de representação do átomo, baseadas nas conclusões de cada época, para melhor explicar a estrutura atômica.
O primeiro modelo científico do átomo é do começo do século XIX, desenvolvido pelo inglês John Dalton, inspirado pelo pensamento newtoniano do século XVIII e começo do XIX. Newton, que faleceu no século XVIII, era entusiasta da teoria corpuscular da matéria, citando as ultimate particles, as quais seriam as menores partículas da matéria.
Dalton, grande entusiasta da meteorologia e exímio estudioso de gases, ao lado de William Henry, desenvolveu um modelo para explicar questões relacionadas à atmosfera e aos gases. Seu modelo, comumente associado com bolas de bilhar (pois era centrado nas massas atômicas relativas), especulou sobre diferenças de massas entre os átomos constituintes das diferentes substâncias elementares.
A partir daí, o estudo do átomo foi se aprimorando com o avanço da ciência. No fim do século XIX, Joseph John Thomson, baseado nos trabalhos de Michael Faraday e William Crookes, descobriu que os fenômenos elétricos têm origem no átomo, descobrindo o elétron.
Depois, no começo do século XX, catapultado pela descoberta da radioatividade, Ernest Rutherford apresentou o modelo atômico mais conhecido, o do sistema solar, mostrando que as partículas negativas deveriam orbitar o núcleo denso e positivo, tal como os planetas orbitam o Sol.
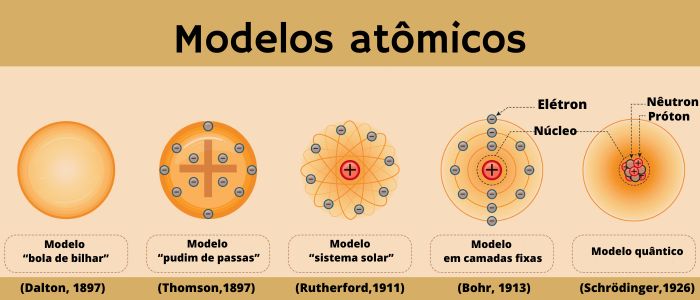
Foi no começo do século XX que a ciência passou também por uma grande revolução, com a descoberta e o desenvolvimento da mecânica quântica. Com ela, Niels Bohr fez correções significativas ao modelo de Rutherford, o qual apresentava problemas de instabilidade.
O átomo de Bohr é o primeiro modelo que se utiliza da mecânica quântica para explicar o comportamento das partículas constituintes do átomo. Contudo, o desenvolvimento da mecânica quântica fez o átomo ser, cada vez mais, aprimorado.
O modelo de Bohr se mostrou certo apenas para um tipo de átomo (os hidrogenóides, com 1 próton e 1 elétron), necessitando-se de complexos modelos matemáticos para se explicar a natureza do átomo. É daí que surgiu o modelo proposto pelo cientista Erwin Schrödinger, cujos cálculos são usados, até hoje, para se entender a estrutura atômica.
História do átomo
O átomo foi inicialmente concebido como uma ideia filosófica desenvolvida por Leucipo de Abdera e Demócrito de Abdera, em meados do século V a.C. Sua concepção se deu como uma oposição à escola dos eleatas. A base do atomismo se deu com a observação de fenômenos que se sucedem no cotidiano.
Leucipo acreditava no movimento dos corpos, e, havendo movimentação, também haveria o vácuo (para que os corpos se movimentassem). Além disso, se os corpos se movimentavam, se havia vácuo, a matéria não seria homogênea, mas heterogênea, formada por corpúsculos.
Tais corpúsculos seriam indivisíveis, partículas fundamentais chamadas de átomos (traduzido como “indivisível” do grego). Abaixo deles nada existiria. Por exemplo, podemos dividir uma garrafa de água em diversos copos, constatando-se a divisibilidade. Tais copos podem ser divididos em volumes menores, depois, em gotas, até que se chegaria em um ponto em que não seria mais possível a divisão. Essa partícula formada, indivisível e fundamental, seria o átomo.
Saiba mais: Camada de valência — camada eletrônica mais externa do átomo
Curiosidades sobre o átomo
- A palavra átomo vem do grego e significa “indivisível”.
- Antes do modelo de sistema solar de Rutherford, o cientista japonês Hantaro Nagaoka, em 1904, propôs o modelo saturniano, em que o átomo seria formado por um caroço central rodeado por anéis de partículas, tal qual o planeta Saturno.
- Em 1924, Louis de Broglie apresentou a ideia de dualidade da partícula. Os elétrons, assim, têm comportamento dual: apresentam comportamento de partícula e de onda, sendo caracterizados como partícula-onda.
- Os prótons, apesar de positivos, são mantidos no núcleo por forças atrativas mais intensas que as forças de repulsão. Tais forças são tão intensas que são conhecidas como “força forte”.
- Uma das partículas subatômicas, o méson pi (ou píon), teve grande contribuição de um cientista brasileiro para sua descoberta, o físico paranaense Cesar Lattes. Seu trabalho foi essencial para o desenvolvimento da área de Física de partículas.
Exercícios resolvidos sobre átomo
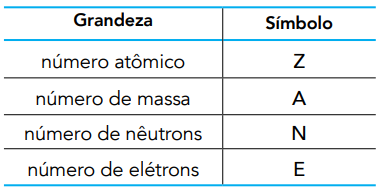
Questão 1. (Uerj) Com base no número de partículas subatômicas que compõem um átomo, as seguintes grandezas podem ser definidas:
O oxigênio é encontrado na natureza sob a forma de três átomos: 16O, 17O e 18O. No estado fundamental, esses átomos possuem entre si quantidades iguais de duas das grandezas apresentadas.
Os símbolos dessas duas grandezas são:
(A) Z e A
(B) E e N
(C) Z e E
(D) N e A
Resposta: Letra C
Sendo as espécies citadas como isótopos, isso quer dizer que elas têm o mesmo número de prótons, ou seja, o mesmo número atômico (Z). Além disso, as espécies são átomos, ou seja, eletricamente neutras. Com isso, podemos concluir que possuem o mesmo número de elétrons (E).
Questão 2. (Uerj) A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da matéria.
Sabe-se que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a:
A) 0,5
B) 1,0
C) 1,5
D) 2,0
Resposta: Letra B
As cargas elétricas presentes no núcleo são os prótons, uma vez que os nêutrons não as possuem. Assim, sendo isótopos, o número de prótons é o mesmo. Uma divisão entre números iguais é sempre igual a 1.
Fontes
CHAVES, L. M. M. P.; DOS SANTOS, W. L. P.; CARNEIRO, M. H. S. História da ciência no estudo de modelos atômicos em livros didáticos de Química e concepções de ciência. Química Nova Na Escola. V. 36, n. 4, p. 269-279, nov. 2014.
DOS SANTOS, H. F.; DE ALMEIDA, W. B. Modelos teóricos para a compreensão da estrutura da matéria. Química Nova Na Escola. n. 4. mai. 2001.
FILGUEIRAS, C. A. L. Duzentos anos da teoria atômica de Dalton. Química Nova Na Escola. n. 20, nov. 2004.
FILHO, E. B.; MATSUMOTO, M. Y. Hantaro Nagaoka e o modelo saturniano. Química Nova Na Escola. v. 44, n. 1, p. 9-16, fev. 2022.
TÉLLEZ, C. A. O atomismo de Leucipo e Demócrito. Química Nova. 15(1). 1992.
UNIFEI. Cesar Lattes. UNIFEI Personalidades do Muro. Disponível em: https://unifei.edu.br/personalidades-do-muro/extensao/cesar-lattes/
VIANA, H. E. B.; PORTO, P. A. O processo de elaboração da teoria atômica de John Dalton. Química Nova Na Escola. n. 7, dez. 2007.


