O cobre é o primeiro metal do grupo 11 da Tabela Periódica. Junto com o ouro, é o único metal que não apresenta coloração prateada, tendo uma cor avermelhada bem característica. O cobre é muito resistente à corrosão, pouquíssimo reativo e é o segundo metal de maior condutibilidade elétrica entre os conhecidos. Seu estado de oxidação mais comum é +2.
Esse elemento é encontrado em diversos minerais, sendo a calcopirita a principal fonte natural desse metal. Utiliza-se cobre na confecção de diversas ligas metálicas, tais como bronze e latão, além da produção de moedas, fios, conectores eletrônicos, tubulação de água e vapor, entre outros produtos. O cobre desempenha um papel muito importante em nossa biologia, sendo um elemento traço de grande necessidade.
Leia também: Alumínio — outro metal que possui alta condutibilidade elétrica
Tópicos deste artigo
- 1 - Resumo sobre o cobre
- 2 - Propriedades do cobre
- 3 - Características do cobre
- 4 - Onde o cobre pode ser encontrado?
- 5 - Obtenção do cobre
- 6 - Aplicações do cobre
- 7 - Cobre na biologia do ser humano
- 8 - História do cobre
Resumo sobre o cobre
- O cobre é um metal pertencente ao grupo 11 da Tabela Periódica, de símbolo Cu.
- Apenas o cobre e o ouro não possuem a coloração prateada característica dos metais, sendo que o cobre possui uma coloração avermelhada quando puro.
- O cobre é altamente resistente à corrosão e muito pouco reativo.
- É o segundo metal de maior condutibilidade elétrica, ficando atrás apenas da prata.
- É encontrado na natureza em diversos minerais, sendo a calcopirita a principal fonte mineral.
- É aplicado na fabricação de diversas ligas metálicas (como latão e bronze), além da confecção de moedas, fios, conectores elétricos, tubulações, entre outros produtos.
- É um elemento traço essencial, sendo necessária sua ingestão diária por nós, seres humanos.
- Foi, talvez, o primeiro metal a ter sido manipulado pelo ser humano em toda a história.
Propriedades do cobre
- Símbolo: Cu.
- Número atômico: 29.
- Massa atômica: 63,546 u.m.a.
- Eletronegatividade: 1,9.
- Ponto de fusão: 1084,62 °C.
- Ponto de ebulição: 2562 °C.
- Densidade: 8,96 g.cm-3 (20 °C).
- Configuração eletrônica: 4s1 3d10.
- Série química: metais, grupo 11, elementos de transição.
Características do cobre

O cobre, símbolo Cu (de cuprum) e número atômico 29, é o primeiro metal do grupo 11 da Tabela Periódica. De coloração avermelhada, é o único metal, junto ao ouro, que não tem a coloração prateada característica dos metais. É também um metal dúctil e maleável.
Entre todos os elementos metálicos da primeira linha do bloco d, é o menos reativo, sendo atacado apenas por ácido sulfúrico concentrado e quente, além de ácido nítrico de qualquer concentração.
Cu + 2 H2SO4 → SO2 + CuSO4 + 2 H2O
Quando em contato com o ar, o cobre pode reagir com alguns ácidos mais diluídos, formando um fino filme esverdeado que consiste no sulfato de cobre II. Também reage com amônia em meio aquoso e, quando aquecido de maneira vigorosa, consegue reagir com o gás oxigênio.
2 Cu + O2 → 2 CuO → Cu2O + ½ O2
Ao aquecer cobre com F2, Cl2 e Br2, há a produção dos haletos de cobre II correspondentes.
É o único elemento da primeira linha dos elementos do bloco d que apresenta estado de oxidação +1 estável, mesmo havendo uma tendência para que ele passe ao estado +2 (mais comum). Em geral, os sais de cobre I são brancos e pouco ou muito pouco solúveis, enquanto os sais de cobre II são solúveis e coloridos. Há também a possibilidade, embora rara, da formação do cobre de cargas +3, como é o caso do K3CuF6, e +4, como é o caso do Cs2CuF6.
Onde o cobre pode ser encontrado?
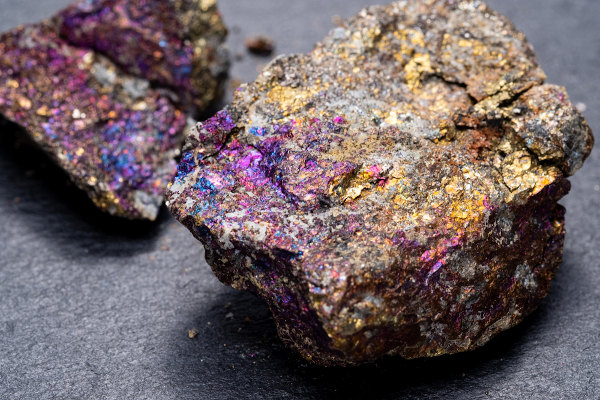
O principal mineral de cobre é a calcopirita (CuFeS2), sendo a malaquita (Cu2(OH)2CO3), calcantita (CuSO4∙5H2O), atacamita (Cu2(OH)3Cl), azurita (Cu3(OH)2(CO3)2) e cuprita (Cu2O) outras fontes minerais interessantes de cobre.
O cobre é bem distribuído pelo planeta, mas com reservas pequenas. As principais reservas naturais de cobre estão no Chile, Austrália, Peru, Rússia e México. O Serviço Geológico dos Estados Unidos aponta que o principal produtor de cobre mineral é o Chile, enquanto a China é a maior produtora de cobre refinado.
Segundo o Anuário Mineral Brasileiro de 2022, que tem o ano de 2021 como base, o cobre representou 5,83% da produção mineral comercializada do Brasil (R$ 18,2 bilhões de reais), com uma produção bruta de 99,5 milhões de toneladas e uma produção beneficiada de 1,1 milhão de toneladas.
Obtenção do cobre
A principal forma de produção do cobre se dá pelo aquecimento da calcopirita, em presença de ar atmosférico, a fim de se produzir, primeiramente, Cu2S e FeS, para depois haver a conversão do Cu2S em Cu.
2 CuFeS2 + O2 → Cu2S + 2 FeS + SO2
2 CuFeS2 + 4 O2 → Cu2S + 2 FeO + 3 SO2
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
2 Cu2O + Cu2S → 6 Cu + SO2
Cu2O + FeS → Cu2S + FeO
10 Cu2O + 3 FeO → 20 Cu + Fe3O4 + 3 SO2
3 Fe3O4 + FeS → 10 FeO + SO2
O FeO produzido reage com SiO2 e forma o FeSiO3, conhecido como escória. O cobre produzido, após a remoção do ferro na forma de silicato, pode ser produzido em diversos teores: 98,5% (blister), 99,7% (anódico) e superior a 99,99% (catódico).
Para se adquirir essas altas concentrações de cobre, coloca-se cobre impuro no ânodo, mais puro no cátodo e o CuSO4 como eletrólito. O cobre, então, migra do ânodo para o cátodo. Contudo, tal processo possui o problema da produção de dióxido de enxofre, SO2, um gás tóxico.
Uma alternativa para a extração de cobre é por meio de um processo hidrometalúrgico em que os minerais são dissolvidos em ácido sulfúrico, extraindo o cobre na forma de CuSO4 aquoso. Tal processo, conhecido como extração eletrolítica e de solventes (SX-EW), é ambientalmente melhor, ainda ocorrendo em temperatura ambiente. A questão, entretanto, é que ainda está muito ligado ao processo tradicional, pois o H2SO4 pode ser obtido como subproduto.
Também é possível fazer uma biolixiviação de minerais de sulfeto de cobre, por meio da bactéria Acidithiobacillus thiooxidans, a qual oxida o íon sulfeto a íon sulfato, podendo ocorrer paralelamente ao processo SX-EW.
Dado o grande consumo de cobre (excedido apenas pelo aço e pelo alumínio), a reciclagem do cobre também é muito bem-vista pelo setor industrial.
Aplicações do cobre

Sendo resistente à corrosão, o cobre é utilizado em tubulações para água quente e vapor, além de partes externas de edifícios, como telhados. As ligas de cobre, como latão (com zinco), bronze (com estanho), níquel-prata (com zinco e níquel) e o produto da cunhagem (com níquel), têm grande interesse comercial.

Entre seus compostos, destaca-se o sulfato de cobre II, um conhecido fungicida.
Contudo, o principal uso do cobre se deve às suas boas condutibilidades elétrica e térmica. Aliás, o grupo do cobre na Tabela Periódica contém os três maiores condutores de eletricidade: prata, cobre e ouro (em ordem de condutibilidade). Assim, o cobre é empregado na fabricação de fios, cabos condutores, conectores de aterramento, entre outros usos.

Veja também: Estanho — o elemento químico que, junto ao cobre, forma o bronze
Cobre na biologia do ser humano
Para os seres humanos, o cobre é um elemento traço essencial, mais especificamente na forma do íon Cu2+. Após Fe e Zn, é o metal mais abundante de que nós, seres humanos, precisamos, sendo necessária a ingestão de 2 a 5 mg diários de cobre.
O cobre se distribui por todo o corpo humano, mas se concentra em maior quantidade nos fígados e rins, órgãos que realizam intensa atividade metabólica. Dessa forma, o cobre previne doenças como anemia, danos celulares, doenças ósseas, entre outras.
Esse elemento está na composição de diversas proteínas e enzimas, participando ativamente da bioquímica do nosso corpo. Animais que possuem sangue verde, como o polvo e alguns artrópodes, têm o cobre como elemento que transporta o oxigênio pelo sangue.
História do cobre
O cobre foi, provavelmente, o primeiro metal a ser trabalho pelo ser humano. É difícil dizer quando ele foi descoberto, mas há indícios de que sua utilização se iniciou há cerca de 7000 anos.
Trata-se de um dos metais protagonistas da Idade do Bronze, que ocorreu entre o terceiro e o primeiro milênio antes de Cristo e permitiu que as sociedades da época saíssem da Idade da Pedra.

O nome cobre deriva do latim cuprum, que vem de cyprium, palavra usada para designar a Ilha de Chipre, a principal fonte natural desse metal no mundo antigo.
Há registros da utilização de cobre no Oriente Médio, assim como na América pré-colombiana, pelo povo inca e outras sociedades que habitam o que hoje delimitados como o Equador. O cobre continua sendo um elemento químico muito utilizado na atualidade.
Crédito de imagem
Por Stéfano Araújo Novais
Professor de Química

