O oxigênio (O) é um elemento químico de número atômico 16 pertencente à antiga família VIA (atual grupo 16), também conhecida como família dos calcogênios. Nesse sentido, ele se caracteriza principalmente por formar a molécula de oxigênio (O2), substância simples, gasosa e incolor que compõe cerca de 21% do ar atmosférico, desempenhando um papel importante na respiração aeróbica e consequente manutenção da vida na Terra. Na sua forma elementar, ele apresenta alta eletronegatividade, podendo formar tanto compostos iônicos quanto moleculares.
Sua descoberta no século XVIII, pelos químicos Carl Wilhelm Scheele e Joseph Priestley, foi extremamente importante, pois a partir dela Antoine Lavoisier conseguiu estabelecer o papel fundamental do oxigênio na combustão e na respiração, desmentindo a teoria do flogisto que era vigente na época. A partir de então, foram exploradas outras aplicações em setores tanto da indústria quanto da medicina, como, por exemplo, na produção de aço e terapias respiratórias, respectivamente.
Leia também: Hidrogênio — detalhes sobre o elemento químico mais abundante no universo
Tópicos deste artigo
- 1 - Resumo sobre o oxigênio
- 2 - Propriedades do oxigênio
- 3 - Características do oxigênio
- 4 - Formas alotrópicas do oxigênio
- 5 - Onde o oxigênio é encontrado?
- 6 - Ocorrência do oxigênio
- 7 - Obtenção do oxigênio
- 8 - Ciclo do oxigênio
- 9 - Função do oxigênio
- 10 - Aplicações do oxigênio
- 11 - Importância do oxigênio
- 12 - Precauções com o oxigênio
- 13 - História do oxigênio
- 14 - Curiosidades sobre o oxigênio
Resumo sobre o oxigênio
-
O oxigênio é o terceiro elemento mais abundante no universo e o mais abundante na crosta terrestre.
-
Constitui cerca de 21% da atmosfera terrestre.
-
É incolor, insípido e inodoro em estado gasoso à temperatura ambiente.
-
É solúvel em água, permitindo a respiração de organismos aquáticos.
-
É altamente reativo e pode formar compostos com muitos elementos.
-
Está presente na água, minerais, solos e rochas, e forma a camada de ozônio, que protege contra radiação UV.
-
É fundamental para a respiração aeróbica, permitindo a produção de energia por meio da glicose.
-
Usado em processos industriais, como produção de aço, oxidação de metais e geração de energia.
-
Possui aplicações na medicina, incluindo terapias de oxigenação e suporte respiratório em emergências.
-
Antoine Lavoisier contribuiu para a compreensão da importância do oxigênio na combustão e na formação de ácidos.
-
Foi descoberto e isolado como elemento no século XVIII por Carl Wilhelm Scheele e Joseph Priestley.
Propriedades do oxigênio
-
Símbolo: O.
-
Massa atômica: 15,999 u.
-
Número atômico: 8.
-
Configuração eletrônica: 1s2 2s2 2p4.
-
Eletronegatividade: 3,44 (na escala Pauling).
-
Série química: não metais.
-
Ponto de fusão: -218,79°C.
-
Ponto de ebulição: -182,96°C.
-
Energia de ionização: 1313,9 kJ/mol (primeira ionização).
-
Afinidade eletrônica: 141 kJ/mol.
-
Densidade: 1,429 g/L (a 0°C e 1 atm, no estado gasoso).
-
Dureza (escala de Mohs): não aplicável (gasoso à temperatura ambiente).
-
Estado de oxidação: -2 (mais comum), +2, +1.
-
Raio atômico (Van der Waals): 152 pm.
Características do oxigênio
Dentre as características mais notáveis do oxigênio, podemos destacar que:
-
É altamente reativo, ou seja, pode combinar-se com muitos elementos para formar compostos, sendo essencial para processos como a combustão e a oxidação.
-
À temperatura ambiente, é um gás incolor, insípido e inodoro que se torna líquido em temperaturas muito baixas.
-
É relativamente solúvel em água, o que é fundamental para a vida aquática, pois permite que os organismos aquáticos respirem.
Vale destacar que na tabela periódica ele se encontra no segundo período e no grupo 16 (antiga família VIA), também conhecida como família dos calcogênios.
Formas alotrópicas do oxigênio
Primeiro, é importante lembrarmos que alotropia são diferentes estruturas moleculares do mesmo elemento químico. No caso do oxigênio, ele possui várias formas alotrópicas, sendo as principais:
-
Oxigênio diatômico (O2): essa é a forma mais comum e estável, composta por dois átomos de oxigênio.
-
Ozônio (O3): formado por três átomos de oxigênio, é menos estável e altamente reativo. Na estratosfera, forma a camada de ozônio, que protege contra a radiação ultravioleta. Ao nível do solo, é um poluente nocivo.
-
Oxigênio atômico (O): um único átomo de oxigênio, altamente reativo e raro na natureza devido à sua tendência de se combinar com outras moléculas.
-
O4 e polioxigênio: menos comuns e instáveis, essas formas são criadas em condições laboratoriais extremas e não têm presença significativa na natureza.
Onde o oxigênio é encontrado?
As formas como o oxigênio pode ser encontrado na natureza são bastante diversificadas, uma vez que ele pode estar tanto em suas formas moleculares simples quanto presente em compostos. Dessa forma, temos sua presença na:
-
Atmosfera: onde ele existe principalmente na forma de moléculas diatômicas.
-
Hidrosfera: na água, o oxigênio está presente na forma de moléculas de água ou dissolvido em pequenas concentrações.
-
Litosfera: na crosta terrestre está na forma de minerais, como a sílica e os carbonatos. Além disso, ele é um componente essencial de muitos compostos orgânicos encontrados em solos e rochas.
Ocorrência do oxigênio
O oxigênio ocorre em diversas formas e locais. Por exemplo, na atmosfera temos ele na sua forma diatômica, o qual é crucial para a respiração dos seres vivos, bem como para os processos de combustão. Além disso, na hidrosfera ele é um componente vital da água (H2O), sendo indispensável para a sobrevivência de organismos aquáticos e terrestres.
No solo e na litosfera, o oxigênio faz parte de uma vasta gama de minerais e rochas, como a sílica (SiO2) e os carbonatos (CaCO3). Ademais, ele é um constituinte de muitos compostos orgânicos, sendo essencial na estrutura de proteínas, carboidratos e lipídios, sem contar que é produzido pelas plantas por meio da fotossíntese, processo que converte dióxido de carbono e água em glicose e oxigênio.
Obtenção do oxigênio
A obtenção do oxigênio pode ser feita principalmente por meio de dois métodos: a destilação fracionada do ar liquefeito e a eletrólise da água. Neste tópico falaremos um pouco dos dois:
-
Destilação fracionada do ar liquefeito: esse é o método mais comum e eficiente para obter oxigênio em grande escala. Nele o ar atmosférico é inicialmente resfriado a temperaturas muito baixas até se tornar líquido. Em seguida, essa mistura de ar liquefeito é aquecida gradualmente em uma coluna de destilação fracionada. Portanto, já que diferentes gases do ar liquefeito têm pontos de ebulição distintos, eles evaporam em diferentes temperaturas. Por fim, o oxigênio, com um ponto de ebulição de -183°C, é separado do nitrogênio (que tem um ponto de ebulição de -196°C) e outros gases.
-
Eletrólise da água: esse método é usado principalmente em laboratórios e para pequenas quantidades de oxigênio, e envolve a passagem de uma corrente elétrica através da água, que é uma solução eletrolítica (normalmente com um pouco de ácido ou sal dissolvido para aumentar a condutividade). Basicamente, a corrente elétrica separa a água em seus componentes: hidrogênio e oxigênio. Sendo assim, o oxigênio é liberado no ânodo (polo positivo), enquanto o hidrogênio é liberado no cátodo (polo negativo).
Ciclo do oxigênio
O ciclo do oxigênio é um ciclo biogeoquímico essencial para manter o equilíbrio ambiental e a vida na Terra, uma vez que ele garante a disponibilidade contínua de oxigênio na atmosfera, sendo necessário para a respiração de organismos aeróbicos, e ajuda a regular o nível de dióxido de carbono, influenciando o clima e o aquecimento global, podendo ser representado da seguinte forma:

Em vista disso, para que você possa compreender melhor, veremos um pouco sobre cada etapa desse processo.
-
Produção de oxigênio: a principal fonte de oxigênio na Terra é a fotossíntese realizada pelas plantas, algas e algumas bactérias, em que esses organismos convertem dióxido de carbono e água em glicose e oxigênio, usando a energia do sol, conforme a seguinte equação química:
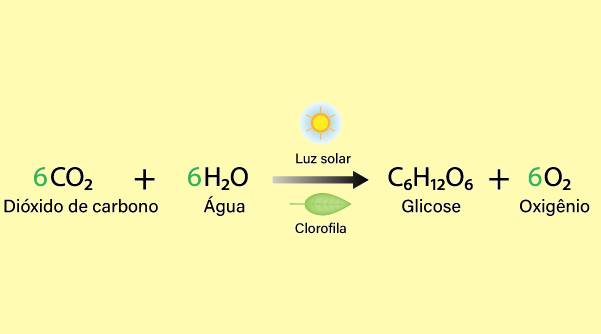
- Liberação de oxigênio: o oxigênio produzido na fotossíntese é liberado para a atmosfera, onde pode ser usado por outros seres vivos, incluindo animais e microrganismos, na respiração.
-
Respiração: na respiração, os seres vivos utilizam o oxigênio para quebrar a glicose, liberando energia para suas funções vitais. Durante esse processo, o oxigênio é consumido e transformado novamente em CO2, que é liberado de volta para a atmosfera.
-
Decomposição: quando os organismos morrem, seus corpos são decompostos por bactérias e fungos. Em consequência disso, o oxigênio presente nos corpos é utilizado na decomposição da matéria orgânica, liberando CO2 e outros compostos.
-
Reciclagem: o dióxido de carbono liberado na decomposição é absorvido pelas plantas durante a fotossíntese, reiniciando o ciclo do oxigênio.
Função do oxigênio
O oxigênio tem como função primordial tornar possível a respiração dos seres vivos, sendo essencial para a produção de energia por meio da quebra da glicose em organismos aeróbicos. Outra função importante é sua capacidade de oxidar materiais orgânicos e inorgânicos, bem como o seu papel crucial na formação de ozônio na estratosfera.
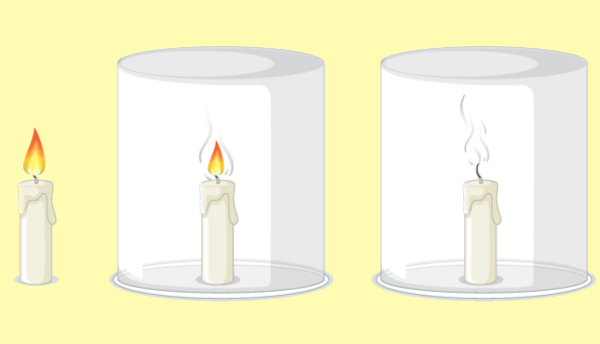
Ademais, ele é fundamental para a combustão, participando ativamente em reações químicas que geram calor e luz, sendo essencial em processos industriais e em motores de combustão interna. Um exemplo clássico é o da vela acesa, que ao ter sua fonte de oxigênio (comburente) limitada por um copo irá apagar, pois todo o oxigênio dentro do copo será consumido em questão de segundos, cessando, assim, a reação de combustão, conforme é ilustrado abaixo:
Aplicações do oxigênio
O oxigênio tem diversas aplicações em nosso dia a dia, tanto na indústria quanto na área da saúde e em outras áreas. A seguir, veja algumas das principais aplicações do oxigênio.
-
Oxigenoterapia e ventilação mecânica: faz o uso de oxigênio medicinal para tratamento de pacientes com problemas respiratórios, ajudando-os a respirar melhor.
- Anestesia: em combinação com outros gases, é usado para anestesiar pacientes durante cirurgias.
-
Soldagem: em processos de soldagem oxiacetilênica, em que o oxigênio é usado para acelerar a combustão de gases.
-
Corte e gravação a laser: é usado para alimentar lasers em processos de corte e gravação de materiais.
-
Metalurgia: usado para a produção de aço em altos-fornos e para a oxidação de metais.
-
Tratamento de águas residuais: é usado para aumentar o teor de oxigênio na água, ajudando a decompor substâncias orgânicas.
-
Mergulho: é usado em misturas respiratórias para mergulhadores, permitindo que respirem em profundidades maiores.

- Aviação: em aeronaves, é usado em sistemas de suporte de vida e para gerar pressão nos sistemas de combustível.
-
Combustíveis: usado em foguetes e motores de foguetes como oxidante para queimar combustíveis.
Acesse também: Nitrogênio — detalhes sobre o elemento químico constituinte principal do ar atmosférico
Importância do oxigênio
No que tange a importância do oxigênio, podemos resumi-la no âmbito de suas funções e aplicações:
-
Permite a obtenção de energia dos alimentos por organismos aeróbicos.
-
Ajuda as plantas a converterem dióxido de carbono em oxigênio, regulando o clima e sustentando a vida.
-
É utilizado na produção de aço, soldagem e corte de metais, e no tratamento de águas residuais.
-
Indispensável em tratamentos respiratórios e cuidados intensivos.
-
O ozônio, uma forma de oxigênio, forma uma camada na estratosfera que filtra os raios ultravioleta do sol.
Precauções com o oxigênio
Parece estranho, mas existem precauções importantes a serem tomadas com o oxigênio devido à sua natureza altamente reativa. Sendo assim, devemos considerar que:
-
Ele é um oxidante poderoso e pode aumentar significativamente a taxa de combustão. Portanto, é essencial mantê-lo longe de materiais inflamáveis e fontes de ignição, como chamas abertas, faíscas e calor excessivo.
-
Em bebês prematuros, a exposição a níveis elevados de oxigênio pode causar o desenvolvimento anormal dos vasos sanguíneos na retina, levando à retinopatia da prematuridade, que pode resultar em cegueira.
-
Ao ser administrado puro pode levar à absorção de nitrogênio dos alvéolos pulmonares, resultando em colapso alveolar (atelectasia) e diminuição da capacidade de oxigenação.
-
A ventilação com ele a alta pressão pode causar danos aos tecidos pulmonares devido ao barotrauma, que é a pressão excessiva nos pulmões.
História do oxigênio
A história do oxigênio é marcada por descobertas científicas importantes para o desenvolvimento da Química e da medicina modernas, além de terem impactado significativamente a indústria e a tecnologia. Nesse sentido, podemos destacar quatro grandes momentos históricos desse elemento:
-
Século XVIII: o oxigênio foi descoberto e isolado como elemento por Carl Wilhelm Scheele e Joseph Priestle. Este último, em particular, observou que o gás produzido pela decomposição do óxido de mercúrio (II) era vital para a combustão e a respiração.
-
Década de 1770: Antoine Lavoisier, um químico francês, investigou o papel do oxigênio na combustão e na respiração. Ele foi o primeiro a propor que o oxigênio era um elemento essencial para a formação de ácidos, revolucionando a Química da época.
-
Séculos XIX e XX: com o avanço da compreensão da bioquímica, tornou-se evidente que o oxigênio é crucial para a respiração aeróbica.
-
Século XX: o oxigênio passou a ser usado em medicina para tratamento de pacientes com dificuldades respiratórias, em soldagem e corte de metais e em outras aplicações industriais.
A palavra “oxigênio” é derivada do grego “oxus” (ácido) e “gennan” (gerar). O nome foi dado pelo químico Antoine Lavoisier no século XVIII, que inicialmente acreditava que o oxigênio era um componente essencial na formação de todos os ácidos. Atualmente, sabemos que isso não é completamente verdadeiro, mas o nome permaneceu. Contudo, seu papel na combustão e na formação de ácidos foi fundamental para o desenvolvimento da Química moderna.
Curiosidades sobre o oxigênio
-
Apesar de ser vital para a vida, o oxigênio foi descoberto apenas em 1774 pelo químico sueco Carl Wilhelm Scheele e isolado em forma gasosa por Joseph Priestley em 1775.
-
Pode ser liquefeito a temperaturas extremamente baixas.
-
Acredita-se que os primeiros organismos na Terra eram anaeróbicos, o que significa que eles não necessitavam de oxigênio para sobreviver. Sendo assim, a produção de oxigênio pela fotossíntese das cianobactérias foi um evento evolutivo crucial, levando à vida aeróbica que conhecemos hoje.
Fontes
CANFIELD, D. E. THE EARLY HISTORY OF ATMOSPHERIC OXYGEN: Homage to Robert M. Garrels. Annual Review of Earth and Planetary Sciences, [s. l.], v. 33, n. 1, p. 1–36, 2005. Disponível em: https://www.annualreviews.org/doi/10.1146/annurev.earth.33.092203.122711.
DOLE, M. The natural history of oxygen. The Journal of general physiology, [s. l.], v. 49, n. 1, 1965.
HANCOCK, J. T. A Brief History of Oxygen: 250 Years on. Oxygen, [s. l.], v. 2, n. 1, p. 31–39, 2022.
HUANG, Jianping et al. The oxygen cycle and a habitable Earth. Science China Earth Sciences, [s. l.], v. 64, n. 4, p. 511–528, 2021. Disponível em: https://link.springer.com/10.1007/s11430-020-9747-1.
KAIDE, C. G.; KHANDELWAL, S. Hyperbaric Oxygen: Applications in Infectious Disease. Emergency Medicine Clinics of North America, [s. l.], v. 26, n. 2, p. 571–595, 2008. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0733862708000060.
KEELING, R. F. The atmospheric oxygen cycle: The oxygen isotopes of atmospheric CO2 and 02 and the 02/N2 ratio. Reviews of Geophysics, [s. l.], v. 33, n. 2 S, p. 1253–1262, 1995.
LEACH, R. M.; REES, P. J.; WILMSHURST, P. Hyperbaric oxygen therapy Dangers of hyperbaric oxygen. BMJ, [s. l.], v. 317, n. 0831, p. 1140–1143, 1998.
NATIONAL LIBRARY OF MEDICINE. Oxygen. Disponível em: https://pubchem.ncbi.nlm.nih.gov/element/8.
ORTEGA, M. A. et al. A general overview on the hyperbaric oxygen therapy: Applications, mechanisms and translational opportunities. [S. l.: s. n.], 2021.
PETSCH, S. T. The Global Oxygen Cycle. In: TREATISE ON GEOCHEMISTRY. [S. l.]: Elsevier, 2014. v. 10, p. 437–473. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/B9780080959757008111.
REINHARD, C. T. et al. Earth’s oxygen cycle and the evolution of animal life. Proceedings of the National Academy of Sciences of the United States of America, [s. l.], v. 113, n. 32, p. 8933–8938, 2016.
WELLER, M. et al. Oxigênio. In: QUÍMICA INORGÂNICA. 6. ed. Porto Alegre: Bookman, 2017. p. 438–440.
WEST, J. B. The strange history of atmospheric oxygen. Physiological Reports, [s. l.], v. 10, n. 6, 2022. Disponível em: https://onlinelibrary.wiley.com/doi/10.14814/phy2.15214.

