O hidrogênio é o primeiro elemento da Tabela Periódica, com apenas 1 próton em seu núcleo. Seu símbolo é H. Em condições ambiente, apresenta-se na forma de um gás diatômico, o di-hidrogênio (H2), também conhecido como gás hidrogênio. É um composto incolor, inodoro, sem gosto, estável em condições ambiente. É conhecido pelos baixos pontos de fusão e ebulição, além da baixa densidade. É uma substância explosiva quando reage com o gás oxigênio ou os halogênios.
O hidrogênio é pouco encontrado em nossa atmosfera na forma livre, mas é extensamente encontrado associado a outros compostos, como a água e compostos orgânicos. É também o elemento mais abundante do Universo, sendo o principal constituinte das estrelas, como nosso Sol.
Suas aplicações são diversas, destacando-se seu uso na produção de amônia e nas sínteses orgânicas. É um combustível de grande interesse, dado seu grande potencial energético, porém encontra muitas barreiras para sua utilização. Seu nome significa “formador de água” e foi dado por Antoine Lavoisier.
Leia também: Nitrogênio — o gás mais abundante da atmosfera terrestre
Tópicos deste artigo
- 1 - Resumo sobre hidrogênio
- 2 - Videoaula sobre hidrogênio
- 3 - Propriedades do hidrogênio
- 4 - Características do hidrogênio
- 5 - Onde o hidrogênio é encontrado?
- 6 - Como se produz hidrogênio?
- 7 - Para que serve o hidrogênio?
- 8 - Precauções com o hidrogênio
- 9 - Isótopos do hidrogênio
- 10 - História do hidrogênio
Resumo sobre hidrogênio
-
O hidrogênio, símbolo H, é o primeiro elemento da Tabela Periódica, com um único próton em sua constituição.
-
Apresenta-se como um gás diatômico, estável em condições ambientes, sendo incolor, inodoro e insípido.
-
Sua combustão é bastante energética, sendo explosiva na presença de oxigênio.
Não pare agora... Tem mais depois da publicidade ;) -
O gás H2 tem baixos pontos de fusão e ebulição, além de baixa densidade.
-
O hidrogênio compõe mais de 90% dos átomos existentes no Universo.
-
É um elemento pouco disponível na atmosfera, mas bem abundante em nosso planeta, haja visto que compõe diversas substâncias, como a água e os hidrocarbonetos.
-
É utilizado na fabricação da amônia e na síntese de compostos orgânicos.
-
Tem três isótopos naturais: o prótio, deutério e trítio.
-
Seu potencial como combustível é amplamente estudado.
Não pare agora... Tem mais depois da publicidade ;) -
Seu nome significa “gerador de água” e foi dado por Antoine Lavoisier.
Videoaula sobre hidrogênio
Propriedades do hidrogênio
-
Símbolo: H
-
Número atômico: 1
-
Massa atômica: [1,00784 a 1,00811] u.m.a
-
Ponto de fusão: -259,1 °C
-
Ponto de ebulição: -252,76 °C
Não pare agora... Tem mais depois da publicidade ;) -
Eletronegatividade: 2,2
-
Densidade: 0,08988 g.L−1; 0,0708 g.mL−1 (líquido, −253 °C); 0,0706 g.mL−1 (sólido, -262 °C)
-
Distribuição eletrônica: 1s1
-
Série química: ametais
Características do hidrogênio
O hidrogênio, símbolo H, é o primeiro elemento da Tabela Periódica, apresentando também a estrutura mais simples: um único próton no núcleo e um único elétron na eletrosfera. Em condições ambiente, apresenta-se na forma do gás hidrogênio, H2, sendo também possível citá-lo como hidrogênio molecular ou di-hidrogênio.
Tal composto é incolor, inodoro e moderadamente solúvel em boa parte dos solventes, sendo estável nas condições citadas, visto que a ligação H─H apresenta uma energia de dissociação considerável (436 kJ.mol−1).
As temperaturas de fusão e ebulição do di-hidrogênio são bem baixas, o que está em consonância com o fato de apenas existirem as fracas forças de Van der Waals entre as moléculas de H2. O gás hidrogênio pode sofrer combustão em contato com o ar, produzindo apenas águas (H2O). Em condições específicas, as reações com gás oxigênio, O2, e halogênios são explosivas.

Em maiores temperaturas, o H2 reage com boa parte dos elementos, seja diretamente, seja com auxílio de catalisadores. Por exemplo, o hidrogênio reduzirá diversos óxidos, seja para óxidos de menor valência, seja com produção de metais. Na presença de catalisadores, o H2 reage com o N2 e forma NH3.
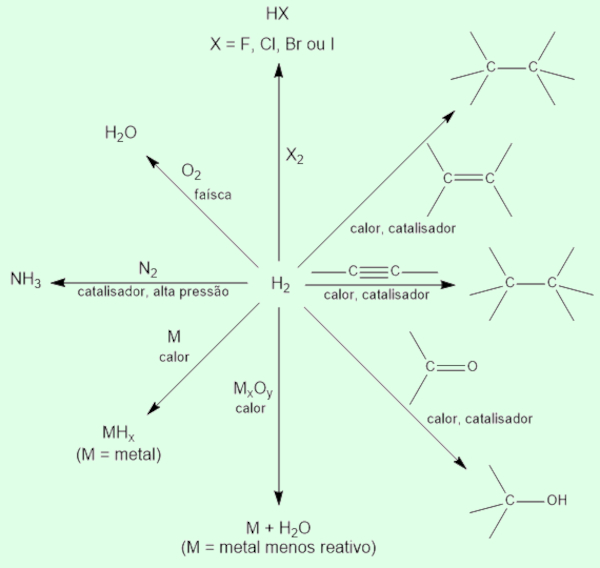
O hidrogênio pode, ainda, formar uma classe de compostos, os hidretos (MHx), tanto com metais quanto com ametais. Em Química orgânica, diversas moléculas orgânicas podem reagir com o gás hidrogênio por meio de catalisadores metálicos. O fluxograma a seguir ilustra as principais reações do gás H2.
Onde o hidrogênio é encontrado?
O hidrogênio é o elemento mais abundante do Universo, e, em nosso planeta, é o terceiro elemento mais abundante (atrás apenas do oxigênio e silício), onde ocorre majoritariamente associado a compostos como a água e compostos orgânicos. Por vezes, o hidrogênio é liberado no processo de decomposição da matéria orgânica, e é possível que haja o H2 nos gases intestinais dos animais.

Quanto ao hidrogênio livre, di-hidrogênio, ele corresponde a cerca de 0,5 ppm de nossa atmosfera. Fora do planeta Terra, é possível encontrar H2 ocluído em meteoritos, além de estar em nebulosas, nas estrelas e no Sol. Avaliações indicam que o gás H2 é responsável por aproximadamente 70% da massa do Sistema Solar, sendo que os planetas maiores (Júpiter, Saturno, Netuno e Urano) apresentam grandes quantidades de H2 em suas atmosferas.
Veja também: O que é o hidrogênio verde?
Como se produz hidrogênio?
O hidrogênio tem formas diferentes de obtenção. Em laboratório, onde quantidades menores são obtidas, o H2 pode ser preparado por meio das reações entre ácidos diluídos e metais adequados (como metais alcalinos, alcalino-terrosos, Fe, Zn etc.); pelo tratamento de metais que formam hidróxidos anfóteros (como Zn e Al); ou pela reação de hidretos metálicos com a água.
2 Fe (s) + 6 HCl (aq) → 2 FeCl3 (aq) + 3 H2 (g)
2 Al (s) + 2 NaOH (aq) + 6 H2O (l) → 2 Na[Al(OH)4] (aq) + 3 H2 (g)
CaH2 (s) + 2 H2O (l) → Ca(OH)2 (aq) + 2 H2 (g)

Metais alcalinos também produzem gás hidrogênio ao reagirem com a água, mas não costumam ser uma rota adequada de produção laboratorial por questões de segurança, já que a reação é extremamente vigorosa.
2 Na + 2 H2O → 2 NaOH + H2
Outro método que permite a produção de H2 em laboratório é a eletrólise da água contendo um eletrólito adequado (com o gás hidrogênio sendo coletado no cátodo). Em eletrodos de platina, pode ser utilizada água acidificada, enquanto um hidrogênio de elevada pureza (acima de 99,99%) pode ser formado na eletrólise de uma solução aquosa aquecida de hidróxido de bário, utilizando-se eletrodos de níquel, conforme a reação demonstrada a seguir.
-
Ânodo: 4 OH− → 2 H2O + O2 + 4 e−
-
Cátodo: 4 H2O + 4 e− → 2 H2 + 4 OH−
Na indústria, o gás hidrogênio pode ser obtido via decomposição eletrolítica da água, utilizando-se como eletrólitos hidróxido de sódio ou hidróxido de potássio. Para essa técnica ser viável, a energia elétrica deve ser barata, deve haver demanda para O2 e H2, além da necessidade de o H2 estar completamente livre de compostos carbônicos.
Reações catalisadas de vapor de água com hidrocarbonetos ou com coque (C) também são aproveitadas na indústria para produção de di-hidrogênio. O craqueamento térmico de hidrocarbonetos é uma etapa importante do refino de petróleo, e, nessa etapa, grandes quantidades de hidrogênio são preparadas. A reação entre vapor de água e metano, oriundo do gás natural, em temperatura próxima a 1100 °C é a que se segue:
CH4 (g) + H2O (g) → CO (g) + 3 H2 (g)
Reação semelhante pode ocorrer com o coque, mas em temperaturas acima de 1000 °C.
C (s) + H2O (g) → CO (g) + H2 (g)
O monóxido de carbono pode, ainda, ser convertido a CO2, com produção de H2, passando-se os gases por um catalisador de ferro ou cobalto em temperatura de 400 °C:
CO (g) + H2O (g) → CO2 (g) + H2 (g)
Para que serve o hidrogênio?
→ Uso comercial do hidrogênio
Comercialmente, o H2 é aproveitado em três processos de extrema importância:
-
No processo Haber-Bosch (para síntese de amônia, NH3):
Não pare agora... Tem mais depois da publicidade ;)
O processo Haber-Bosch é o principal processo industrial para produção de amônia, amplamente utilizada na fabricação de fertilizantes, já que o nitrogênio é um dos macronutrientes das plantas.
-
Na produção de gorduras saturadas via hidrogenação de óleo líquido vegetal:
As gorduras saturadas têm grande aplicação na indústria alimentícia, compondo as diversas gorduras comestíveis a que temos acesso, como margarina, além de biscoitos, sorvetes, chocolates, salgadinhos, entre outros.
-
Na produção de compostos orgânicos:
Dentre os compostos orgânicos feitos com auxílio do H2, destaca-se o metanol, CH3OH, precursor químico de uma série de compostos, como formaldeído, ácido acético, metacrilato de metila, além de ter demanda de uso como combustível. O processo de produção de metanol de H2 se inicia com a produção do gás hidrogênio por meio do metano e do monóxido de carbono, com vapor de água em alta temperatura (como demonstrado anteriormente).
O monóxido de carbono, então, reage com o gás hidrogênio e forma metanol em temperaturas que variam de 200-300 °C, com catalisador de cobre em óxido de zinco.
CO + 2 H2 → CH3OH
CO2 + 3 H2 → CH3OH + H2O
→ Uso do hidrogênio como combustível
O hidrogênio é muito estudado e explorado como combustível. Por exemplo, o di-hidrogênio pode ser empregado como combustível para foguetes. A combustão do H2 é muito bem-vista, pois, além de ser altamente exotérmica, tem como produto único a água, demonstrando que o gás hidrogênio é um combustível completamente limpo.
H2 (g) + ½ O2 (g) → H2O (l) ΔH = −286 kJ/mol H2
Embora promissor na redução da dependência dos combustíveis fósseis, deve-se atentar à pouca disponibilidade do H2 em nosso planeta. Além disso, as rotas de produção em larga escala de H2 não envolvem reagentes renováveis, tornando-se um grande objetivo para os cientistas. Uma das alternativas estudadas é a decomposição da molécula de água por processos elétricos, aproveitando-se a energia oriunda do Sol, em um processo conhecido como fotólise.
-
Gás hidrogênio em automóveis
Além de outras questões técnicas, a utilização de H2 em automóveis tem grandes desafios relacionados à segurança, aos custos, ao armazenamento, à aceitação da população, à disputa de mercado, além da performance.
Em 1839, William Grove observou que, quando se desligava a corrente de uma célula eletrolítica com eletrodos de platina em que água estava sendo eletrolisada para produzir O2 e H2, uma pequena corrente continuava a fluir, mas na direção oposta. Essa foi a primeira percepção das células combustíveis (do inglês, fuel cell), em que energia química produzida pela seguinte reação era eficientemente convertida em energia elétrica:
2 H2 + O2 → 2 H2O
Tais observações permitiram diversas pesquisas no campo das células de combustível de hidrogênio, principalmente no século XX. As montadoras asiáticas Honda, Toyota e Hyundai chegaram a produzir modelos FCV (do inglês, Fuel Cell Vehicles) que utilizavam hidrogênio (e oxigênio) para produção de energia elétrica, esta utilizada para o funcionamento das baterias que alimentariam o carro, entre os anos de 2014 e 2016 (FCX Clarity, Mirai e ix35 FCEV).
A essa altura, os principais desafios eram relacionados ao armazenamento e à distribuição de H2 combustível. Dada sua baixa densidade, o H2 deve ser comprimido sob altas pressões, exigindo tanques mais fortes e resistentes. Vale salientar que o peso do tanque é muito importante, por isso, os fabricantes chegaram a produzi-lo com fibra de carbono.

Em termos de performance, de fato, o gás hidrogênio entrega incríveis 120 MJ.kg−1 (contra cerca de 50 MJ.kg−1 da gasolina); porém a baixa densidade faz com que, por unidade de volume (o que importa para um carro), esse valor fique na faixa 9 GJ.m−3, bem abaixo dos cerca de 35-40 GJ.m−3 da gasolina. Para aumentar esse valor, as montadoras estão buscando tanques de combustível que aguentem condições em que seja possível pressurizar ainda mais o gás hidrogênio.
Precauções com o hidrogênio
As preocupações com hidrogênio envolvem seu manuseio enquanto combustível. Como um gás inflamável e explosivo, requer cuidados. Para começar, é difícil perceber um vazamento de hidrogênio sem um sensor apropriado, visto que ele é inodoro, incolor e insípido.
Contudo, deve-se dizer que ele se dissipa muito mais rápido que outros compostos, como o gás natural, muito por conta de sua baixa densidade. Assim, apenas ambientes mal ventilados e confinados com vazamento de hidrogênio podem ser um perigo em termos de explosão.
O hidrogênio, quando comprimido em tanques, não é explosivo, pois precisa de oxigênio (ou outro oxidante) em concentrações adequadas para desenvolver tal reação.
Saiba mais: Qual é a potência de uma bomba de hidrogênio?
Isótopos do hidrogênio
O hidrogênio tem três isótopos que ocorrem naturalmente: 1H (prótio, o mais comum, H), 2H (deutério, D) e 3H (trítio, T). O que chama a atenção é que os isótopos do hidrogênio têm diferenças em propriedades físicas mais significativas que os isótopos de quaisquer outros elementos. Isso tudo é consequência direta das diferenças de massa, que causam alterações nos movimentos vibracionais, translacionais e rotacionais dos compostos desses isótopos.
As tabelas a seguir trazem algumas diferenças entre os isótopos e seus compostos.
|
|
Prótio |
Deutério |
Trítio |
|||
|
H2 |
H2O |
D2 |
D2O |
T2 |
T2O |
|
|
Massa molecular |
2,016 |
18,015 |
2,028 |
20,028 |
3,032 |
22,032 |
|
Ponto de fusão (°C) |
−259,1 |
0 |
−254,3 |
3,81 |
−252,4 |
- |
|
Ponto de ebulição (°C) |
−252,76 |
100 |
−249,3 |
101,42 |
−248 |
101,51 |
|
Densidade máxima do líquido (g.cm−3) |
- |
0,999972 |
- |
1,10600 |
- |
1,21501 |
O prótio corresponde a 99,985% do hidrogênio existente, enquanto o deutério corresponde a 0,0156%. O trítio é muito raro, estimando-se que, para cada 1017 a 1018 átomos de hidrogênio, 1 será de 3H.
O deutério é produzido da água pesada (ou deuterada, D2O), produzida por meio do enriquecimento eletrolítico da água convencional. A água deuterada é usada em reatores nucleares como moderadora, diminuindo a velocidade dos nêutrons e, assim, controlando as reações nucleares. Já o trítio ocorre nas camadas superiores da atmosfera, sendo formado por meio da reação do nitrogênio com nêutrons oriundos do espaço sideral:
\({}^{14}_{7}N + {}^{1}_{0}n \rightarrow {}^{12}_{6}C + {}^{3}_{1}H \)
Em laboratório, o trítio foi inicialmente produzido por meio do bombardeamento de átomos de deutério com nêutrons acelerados, mas agora é produzido do deutereto de lítio (LiD), fluoreto de lítio (LiF) ou de uma liga Mg/Li enriquecida com 6Li.
\({}^{6}_{3}\text{Li} + {}^{1}_{0}n \rightarrow {}^{4}_{2}\text{He} + {}^{3}_{1}H \)
O trítio é radioativo e é usado como marcador isotópico em processos reacionais da área de Química e bioquímica.
História do hidrogênio
Em nosso Universo, estima-se que o hidrogênio (com o hélio) tenha surgido cerca de 379 mil anos após o Big Bang. A partir do momento em que o Universo embrionário, até então uma mistura quente e densa de plasma de prótons, elétrons e fótons, começou a esfriar e expandir, elétrons e prótons se uniram para formar os átomos.
Cerca de 400 milhões de anos depois, as estrelas (como nosso Sol) evoluíram por meio de nuvens de gás de hidrogênio colapsadas gravitacionalmente, provendo o calor necessário para sustentar a vida em um abismo cósmico gigante e gelado a 2,7 K de temperatura (-270 °C aproximadamente).

Há 4,4 bilhões de anos, mais um marco na história do hidrogênio, quando o planeta Terra começou a ter sua temperatura abaixo dos 100 °C, permitindo que o óxido de di-hidrogênio, H2O, começasse a condensar em sua superfície, dando início à vida nos novos ambientes aquáticos.
Embora Robert Boyle tenha descrito, em 1671, a formação de bolhas gasosas por meio da reação de ferro com ácidos, foi Henry Cavendish que reconheceu o H2 (até então conhecido como “ar inflamável”) como uma substância distinta de outros gases e que, quando queimada na presença de “ar deflogisticado” (oxigênio), produzia água. Tal feito inspirou o francês Antoine Lavoisier a chamar a substância gasosa de hydro-gen, ou seja, “geradora de água”, em 1783.
Nota
|1| KAKIUCHI, M. Hydrogen: Inorganic Chemistry. In: Encyclopedia of Inorganic Chemistry. 2. ed. Wiley: Nova Jersey, 2005.
Créditos da imagem
Karolis Kavolelis/ Shutterstock
Fontes
GROCHALA, W. First there was hydrogen. Nature Chemistry. v. 7, n. 264, fev. 2015.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 2. ed. Pearson Education Limited: Londres, 2005.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
KAKIUCHI, M. Hydrogen: Inorganic Chemistry. In: Encyclopedia of Inorganic Chemistry. 2. ed. Wiley: Nova Jersey, 2005.
U. S. DEPARTMENT OF ENERGY. Hydrogen Safety. Disponível em: https://www1.eere.energy.gov/hydrogenandfuelcells/pdfs/h2_safety_fsheet.pdf


