O número atômico é a quantidade de prótons contidos no núcleo de um átomo. Ele é um dos conceitos mais importantes na Química, pois por meio dele foi possível compreender a estrutura e o comportamento dos átomos, bem como as unidades fundamentais da matéria. Ou seja, ele não apenas identifica de forma única cada elemento químico na Tabela Periódica, mas também desempenha um importante papel na determinação das propriedades químicas e físicas de um elemento. Além disso, desde a sua descoberta nos átomos, cientistas perceberam que a quantidade de prótons no núcleo é o que define a essência de um elemento, diferenciando, por exemplo, o hidrogênio do carbono ou o ferro do ouro.
Leia também: O que é a massa atômica?
Tópicos deste artigo
- 1 - Resumo sobre número atômico
- 2 - Videoaula sobre número atômico
- 3 - O que é número atômico?
- 4 - Para que serve o número atômico?
- 5 - Número atômico x número de massa
- 6 - Como calcular o número atômico?
- 7 - Número atômico na Tabela Periódica
- 8 - Importância do número atômico
- 9 - Estrutura do átomo
- 10 - Exercícios resolvidos sobre número atômico
Resumo sobre número atômico
-
O número atômico é a quantidade de prótons contidos no núcleo de um átomo.
-
O número atômico é representado pela letra Z.
-
Cada elemento químico possui um número atômico único, que o diferencia dos demais.
-
Ele serve para organizar os elementos na Tabela Periódica em ordem crescente.
-
Determina as propriedades químicas do elemento.
-
Em um átomo neutro, o número atômico é igual ao número de elétrons.
-
Ele é obtido pela contagem dos prótons no núcleo do átomo ou pela relação:
Z = A – N.
Videoaula sobre número atômico
O que é número atômico?
O número atômico é o número de prótons presentes no núcleo de um átomo, representado pela letra Z. Nesse sentido, cada elemento químico possui um número atômico específico, que o diferencia dos demais. Por exemplo, o hidrogênio tem número atômico 1, pois seu núcleo contém um próton, enquanto o oxigênio tem número atômico 8, por possuir oito prótons. Sendo assim, todos os átomos de um mesmo elemento são idênticos em número de prótons e juntos constituem a identidade desse elemento.
Para que serve o número atômico?
O número atômico serve para três propósitos principais. O primeiro desses propósitos é identificar um elemento químico, visto que os prótons são as partículas do átomo responsáveis por determinar a identidade de cada elemento. Além disso, diferentemente do número de elétrons ou de nêutrons, eles não podem ser alterados, pois caso isso aconteça, haverá a transformação de um elemento em outro, como é o caso das reações de fissão nuclear e fusão nuclear, em que na primeira há uma fissão de núcleos e na segunda há fusão de núcleos. Em ambos os processos há formação de novos núcleos atômicos, ou seja, novos números de prótons e, portanto, novos elementos químicos.
Em segundo lugar, temos uma consequência nas propriedades físicas e químicas, pois para cada número atômico haverá um elemento químico diferente com propriedades e características distintas.
Por último, o número atômico determina a posição do elemento na Tabela Periódica, facilitando o processo de consulta e cálculos químicos.
Número atômico x número de massa
Apesar de serem dois conceitos distintos, o número atômico (Z) e o número de massa (A) estão relacionados, e são usados para descrever átomos. Em vista disso, podemos compará-los por meio de seus conceitos:
-
Número atômico: representa o número de prótons no núcleo de um átomo. Por exemplo, todos os átomos de oxigênio têm número atômico 8, o que significa que todos têm 8 prótons.
-
Número de massa: é a soma do número de prótons e nêutrons no núcleo de um átomo. Como os nêutrons e prótons são as partículas que contribuem significativamente para a massa do núcleo, o número de massa indica a “massa” total do núcleo. Por exemplo, se um átomo de carbono tem 6 prótons e 6 nêutrons, seu número de massa será 12.
De modo genérico, ao representar um elemento químico por meio do seu símbolo químico, podemos indicar os seus números atômico e de massa da seguinte forma:
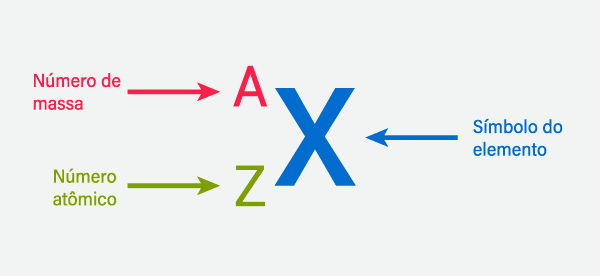
Como calcular o número atômico?
O número atômico (Z) de um elemento é igual ao número de prótons (P) em seu núcleo, e a massa atômica (A) é a soma do número de prótons e número de nêutrons (N). Posto isso, para calcular o número atômico dispomos da seguinte expressão:
A = Z + N
ou
A = P + N
Portanto, o número atômico pode ser obtido da seguinte forma:
Z = A – N
Desse modo, para calcular o número atômico, basta identificar o número de nêutrons e subtrair do número de massa. Em termos práticos, imagine que você precisa determinar o número atômico de determinado elemento, sabendo que um de seus isótopos tem 24 nêutrons, representado da seguinte forma: z50X .
De forma simples, faça a subtração:
Z = A - N
Z = 50 – 24
Z = 26
Número atômico na Tabela Periódica
Na Tabela Periódica, o número atômico é o principal critério para organizar os elementos. Ele aparece geralmente acima do símbolo atômico de cada um deles, e já vimos que ele indica quantos prótons existem no núcleo de seus átomos. Como regra, os elementos na tabela estão dispostos em ordem crescente de número atômico, começando pelo hidrogênio, que tem número atômico 1, até os elementos mais pesados, conforme a tabela a seguir.

Ademais, o número atômico define as propriedades químicas de um elemento e sua posição na tabela. Por exemplo, todos os elementos em uma mesma coluna (ou grupo) têm propriedades químicas semelhantes porque têm a mesma quantidade de elétrons na camada mais externa, mas o número atômico, que indica o número de prótons, é o que realmente determina o elemento em si.
Importância do número atômico
A importância do número atômico se dá principalmente pela sua característica de definir a identidade de um elemento químico, bem como organizá-lo juntamente com os outros elementos na tabela em ordem crescente, o que facilita a previsão de suas propriedades químicas e físicas. Além disso, como ele indica a quantidade de elétrons em um átomo neutro, influencia, também, diretamente em como o elemento reage quimicamente.
Veja também: O que é o raio atômico?
Estrutura do átomo
A estrutura do átomo é geralmente descrita como um núcleo denso, composto de prótons e nêutrons, cercado por uma “nuvem” de elétrons que ocupam diferentes níveis de energia ao redor do núcleo, conforme é ilustrado a seguir:
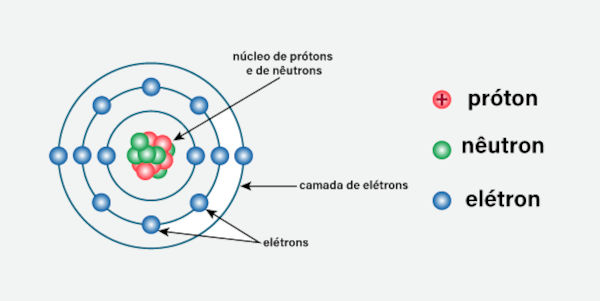
É importante ressaltar as cargas elétricas dessas partículas que influenciam no comportamento do átomo:
-
Prótons: partículas com carga positiva (+).
-
Nêutrons: partículas sem carga (neutras).
-
Elétrons: partículas com carga negativa (-), muito menores que prótons e nêutrons.
Exercícios resolvidos sobre número atômico
Questão 1
(PUC) O elemento selênio (Se) tem massa atômica igual a 78,96 u.m.a. Os dois isótopos mais abundantes do selênio são o 80Se e o 78Se. Sobre esses isótopos de selênio, é correto dizer que eles têm
A) o mesmo número de massa.
B) abundâncias percentuais iguais.
C) o mesmo número de nêutrons.
D) diferentes configurações eletrônicas quando átomos de ambos se encontram neutros.
E) o mesmo número de prótons.
Resolução:
Alternativa E.
Isótopos são átomos de um mesmo elemento químico, ou seja, possuem o mesmo número de prótons (número atômico). Eles diferem entre si no número de nêutrons e, consequentemente, nos números de massa.
Questão 2
(PUC) O urânio ![]() é um elemento químico radioativo utilizado na construção da bomba atômica lançada na cidade de Hiroshima, no Japão, durante a Segunda Guerra Mundial. O átomo de urânio apresenta:
é um elemento químico radioativo utilizado na construção da bomba atômica lançada na cidade de Hiroshima, no Japão, durante a Segunda Guerra Mundial. O átomo de urânio apresenta:
A) 235 prótons, 92 nêutrons, 92 elétrons e massa igual a 184.
B) 92 prótons, 143 nêutrons, 92 elétrons e massa igual a 235
C) 143 prótons, 235 nêutrons, 92 elétrons e massa igual a 92.
D) 92 prótons, 92 nêutrons, 235 elétrons e massa igual a 92.
Resolução:
Alternativa B.
Ao extrair as informações explicitas do enunciado, temos a massa atômica 235 e número de prótons igual a 92. Além disso, leva-se em conta o átomo de urânio na sua forma neutra, o que significa que o número de elétrons é igual ao número de prótons, ou seja, 92. Por fim, a única informação implícita é o número de nêutrons, que pode ser obtido ao subtrair o número de prótons do número de massa:
\(N = A - Z \rightarrow N = 235 - 92 \rightarrow N = 143\)
Fontes
FELTRE, R. Identificação dos átomos. In: Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1p. 81–83.
FELTRE, R.; YOSHINAGA, S. Estrutura do átomo. In: Atomística: teoria e exercícios. São Paulo: Editora Moderna, 1974. v. 2p. 121–176.
REIS, M. Notações químicas. In: Química 1 - Ensino Médio. 1a ed. São Paulo: Editora Ática, 2013. v. 1p. 117–118.


