O argônio, símbolo Ar, é um gás nobre do terceiro período da Tabela Periódica. É majoritariamente composto pelo isótopo de massa 40. Como os demais gases nobres, o argônio apresenta-se, em condições ambientes, como um gás incolor, inodoro, insípido e inerte quimicamente.
Esse elemento possui uma alta energia de ionização, a maior de seu período, o que dificulta a formação de compostos de Ar. Assim sendo, a química desse elemento se centra na sua forma monoatômica. O argônio pode ser usado como atmosfera inerte e como gás de proteção em soldas. No ar atmosférico, é o terceiro maior constituinte, ficando atrás apenas de N2 e O2. Foi descoberto no final do século XIX por Lord Reyligh e William Ramsay.
Leia também: Quais elementos integram a Tabela Periódica?
Tópicos deste artigo
- 1 - Resumo sobre o argônio
- 2 - Propriedades do argônio
- 3 - Características do argônio
- 4 - Onde o argônio pode ser encontrado?
- 5 - Obtenção do argônio
- 6 - Aplicações do argônio
- 7 - História do argônio
Resumo sobre o argônio
- O argônio é um gás nobre (grupo 18 da Tabela Periódica), majoritariamente composto pelo isótopo de massa 40.
- O argônio, como os demais gases nobres, apresenta-se como um gás monoatômico em temperatura ambiente, sendo inerte quimicamente, insípido, inodoro e incolor.
- Sua alta energia de ionização dificulta a obtenção de compostos.
- É o terceiro maior constituinte da atmosfera terrestre.
- Pode ser usado como atmosfera inerte, como gás protetor em solda, além de outros usos.
- Foi descoberto no fim do século XIX, por meio dos estudos de Lord Reyligh e William Ramsay.
Propriedades do argônio
- Símbolo: Ar.
- Número atômico: 18.
- Massa atômica: 39,948 u.m.a.
- Eletronegatividade: --
- Ponto de fusão: -189,36 °C.
- Ponto de ebulição: -185,85 °C.
- Densidade: 1,7837 g.L-1.
- Configuração eletrônica: 1s2 2s2 2p6 3s2 3p6.
- Série química: ametais, grupo 18, elementos representativos, gases nobres.
Características do argônio
O argônio, símbolo Ar, assim como os demais gases nobres, é incolor, inodoro, insípido, com baixo ponto de ebulição e se apresenta como um gás monoatômico. Na forma líquida, também é incolor e ao congelar, forma um sólido cristalino.
Apresenta uma solubilidade em água semelhante à do gás oxigênio, sendo cerca de 2,5 vezes maior que do gás nitrogênio.

Assim como os demais gases nobres, apresenta o maior valor de energia de ionização de seu período (no caso do Ar, o terceiro): 1521 kJ.mol-1. A alta energia de ionização do argônio dificulta a formação de compostos. Não à toa, tal elemento é considerado quimicamente inerte, diferentemente dos gases nobres mais pesados (Kr e Xe, por exemplo), cujas energias de ionização, apesar de altas, são semelhantes a de outros elementos existentes na Tabela Periódica.
Por isso, é possível dizer que a química do argônio ainda engatinha. Mesmo assim, nos anos 2000, relatou-se a produção do primeiro composto “estável” de argônio, o HArF. Embora estável em temperaturas baixas, em temperatura ambiente a substância se decompõe rapidamente.
É majoritariamente composto pelo isótopo de massa 40 (99,60% de abundância), mas também existem outros dois isótopos do Ar: o de massa 38 (0,06% de abundância) e o de massa 36 (0,34% de abundância).
Onde o argônio pode ser encontrado?
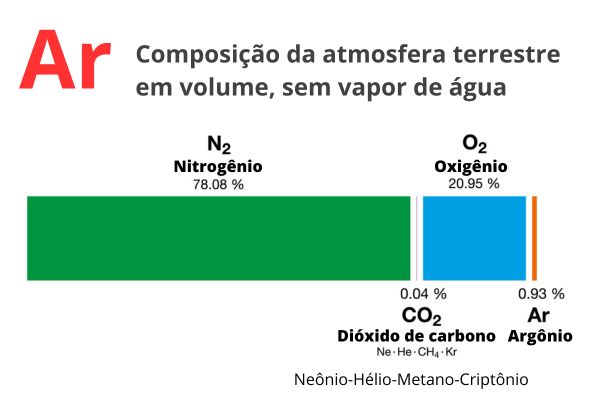
A principal fonte de argônio é o ar atmosférico, onde figura como o terceiro composto mais abundante (0,93% em volume, 1,29% em massa), ficando atrás apenas dos gases nitrogênio e oxigênio. Estima-se que o argônio é o 12º elemento mais abundante do Universo.
Há também níveis de argônio (na forma do isótopo 40Ar) no solo, formado por meio do decaimento do isótopo radioativo do potássio, o 40K. Esse argônio, lentamente, passa das amostras minerais para a atmosfera terrestre.
Leia também: Hélio — o segundo elemento mais abundante do Universo
Obtenção do argônio
Dentre os gases nobres, o argônio é o mais barato. Contudo, assim como os demais gases nobres, o Ar é obtido via destilação fracionada do ar liquefeito.
A única questão com o argônio é o fato de ele possuir um ponto de ebulição muito próximo ao do gás oxigênio (-185,85 °C para o Ar, -182,96 °C para o O). Assim sendo, a separação de ambos é feita pela adição de gás H2 ao argônio bruto. Uma pequena faísca faz o O2 reagir com o H2 e assim removê-lo na forma de H2O. O excesso de H2 é retirado ao passar por CuO quente.
Aplicações do argônio
O argônio, por conta de sua inércia química, é utilizado como atmosfera inerte em experimentos e alguns dispositivos, como lâmpadas incandescentes (de modo a reduzir a evaporação do filamento). A inércia do argônio também é explorada em soldas, quando o gás é utilizado para proteção de peças metálicas fundidas durante a solda. A presença do gás nobre impede que o metal fundido tenha contato com o oxigênio presente no ar atmosférico, assim garantindo uma maior qualidade final para a solda.
Ainda aproveitando a inércia do Ar, extintores de incêndio à base de argônio foram criados, com a finalidade de extinguir incêndios em ambientes com materiais delicados, tais como microcomputadores, documentos, livros, fotografias, acervos, entre outros. Isso porque o Ar não danifica os objetos, não é tóxico para o ser humano e não reduz a visibilidade do ambiente.
O processo radioativo de transformação do 40K em 40Ar em rochas é utilizado como forma de datação e foi empregado para auxiliar na estimativa da idade do planeta Terra, já que o tempo de meia-vida do potássio-40 é de cerca de 1,25 x 109 anos.
História do argônio
As primeiras evidências de um componente inerte no ar ocorreu em 1785, quando Henry Cavendish detectou cerca de 1% dele em seus estudos. À época, Cavendish não conseguiu identificar tal substância, a qual, posteriormente, seria confirmada como o argônio.
A descoberta do argônio é atribuída aos cientistas John William Strutt, o Lord Rayleigh, e sir William Ramsey. Mais de 100 anos após Cavendish, em 1892, Rayleigh e Ramsey conseguiram comprovar que a densidade do gás nitrogênio preparado pela remoção de gás oxigênio, dióxido de carbono e água do ar atmosférico com cobre aquecido se diferia da densidade do gás nitrogênio obtido por meio da amônia, NH3. Assim, ambos entenderam que um novo elemento seria a razão para tal.
Dois anos depois, utilizando a espectroscopia — algo que não havia na época de Cavendish —, os cientistas conseguiram fazer a identificação desse novo elemento. Como tal elemento se mostrava inerte, Ramsey sugeriu a Rayleigh que ele fosse chamado de argônio, em referência à palavra grega argos, que poderia ser traduzida como ociosa, parada, preguiçosa ou inativa.
Os estudos e descobertas com gases fizeram com que ambos fossem laureados com o Prêmio Nobel no ano de 1904: Rayleigh com o de Física e Ramsey com o de Química.
Algumas curiosidades cercam a descoberta do argônio. Em primeiro lugar, ele não se encaixava na Tabela Periódica proposta por Mendeleev, fazendo com que Ramsey sugerisse a criação da coluna adicional, referente aos elementos do grupo 18. Em segundo lugar, o hélio já era conhecido desde 1868, contudo apenas se sabia da sua presença no Sol e em outras estrelas, fazendo o argônio ser considerado o primeiro gás nobre a ser descoberto no planeta Terra.
Por Stéfano Araújo Novais
Professor de Química

