O criptônio, símbolo Kr, é um gás nobre de número atômico 36. Localiza-se no quarto período da Tabela Periódica, e, como os demais do seu grupo, é incolor, inodoro e ocorre em pequenas quantidades na atmosfera terrestre. Sua descoberta se deu, em 1898, por Sir William Ramsay e Morris Travers.
O criptônio é o gás nobre mais leve a fazer compostos que podem ser isolados em quantidades macroscópicas, sendo o principal composto o KrF2, um oxidante fortíssimo, cujo comportamento químico chama a atenção de pesquisadores da área. Sua produção comercial se dá por destilação fracionada do ar liquefeito, mas o isótopo 85 desse elemento é produto da fissão do urânio.
Leia também: Césio-137 — o isótopo radioativo do metal alcalino césio
Tópicos deste artigo
- 1 - Resumo sobre o criptônio
- 2 - Propriedades do criptônio
- 3 - Características do criptônio
- 4 - Obtenção do criptônio
- 5 - Aplicações do criptônio
- 6 - História do criptônio
- 7 - Curiosidades do criptônio
- 8 - Exercícios resolvidos sobre criptônio
Resumo sobre o criptônio
-
É um gás nobre de número atômico 36.
-
Tem baixa presença no ar atmosférico, cerca de 1 ppm.
-
É inodoro e incolor, como os demais gases nobres.
-
Pode formar o composto KrF2, um poderoso oxidante.
Não pare agora... Tem mais depois da publicidade ;) -
É produzido por meio da destilação fracionada do ar atmosférico liquefeito.
-
É aplicado em lâmpadas incandescentes para aumentar sua eficiência e até na detecção de atividades nucleares.
-
Foi descoberto, em 1898, por Sir William Ramsay e Morris Travers.
-
Seu nome inspirou o do planeta do Super-Homem, Krypton.
Propriedades do criptônio
-
Símbolo: Kr
-
Número atômico: 36
Não pare agora... Tem mais depois da publicidade ;) -
Massa atômica: 83,798 u.m.a
-
Configuração eletrônica: 4s2 3d10 4p6
-
Ponto de fusão: -157,37 °C
-
Ponto de ebulição: -153,41 °C
-
Densidade: 3,425 x 10-3 g.cm-3
-
Série química: bloco p, gases nobres
Não pare agora... Tem mais depois da publicidade ;)
Características do criptônio
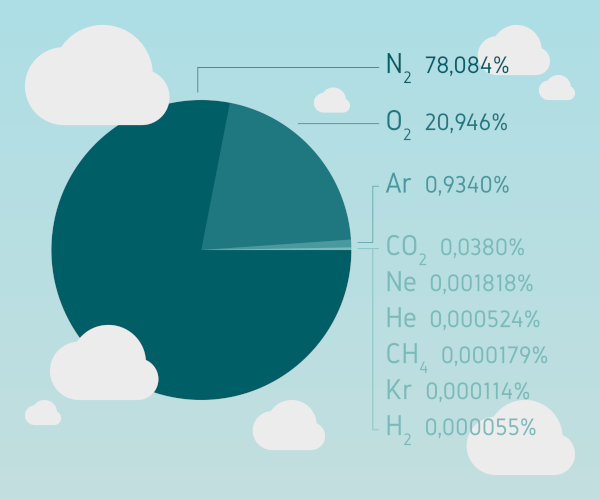
Como todos os gases nobres, o criptônio é incolor, inodoro e ocorre em um pequeno percentual na atmosfera terrestre (cerca de 1,4 mg para cada quilograma de ar seco). Embora muita gente ainda associe gases nobres à inércia química, hoje não podemos mais defini-los como compostos que não reagem. Em 1962, o pesquisador Neil Bartlett, da University of British Columbia, conseguiu produzir a primeira substância composta e estável de um gás nobre ao reagir o gás xenônio, Xe, com hexafluoreto de platina, PtF6.
No ano seguinte, em 1963, o grupo de cientistas Grosse, Kirshenbaum e Streng conseguiu sintetizar o primeiro composto de criptônio, o difluoreto de criptônio (KrF2), embora tenha sido inicialmente reportado de forma errônea como KrF4.
Criptônio e xenônio são os únicos gases nobres capazes de produzir compostos isoláveis em quantidades macroscópicas, sendo o KrF2 o mais simples de todos esses compostos. Aliás, o difluoreto de criptônio é muito importante para pesquisadores da área, pois toda a química desse elemento parte desse composto.
Obtenção do criptônio
Apesar de muito raro, comercialmente, o criptônio por ser obtido por meio de destilação fracionada do ar liquefeito, ou seja, após todos os compostos do ar condensarem, eles são separados pelos seus diferentes pontos de ebulição.
Também é possível obter um isótopo radioativo de criptônio, o 85, por meio da fissão nuclear do urânio radioativo que ocorre em reatores nucleares. Esse isótopo é produzido com um rendimento na faixa de 0,3% e tem um tempo de meia-vida de 10,8 anos, decaindo para o isótopo 85Rb, não radioativo.
Confira no nosso podcast: Como funcionam as usinas nucleares?
Aplicações do criptônio
O criptônio pode ser utilizado em lâmpadas incandescentes que tenham filamento de tungstênio. A ideia é retardar a evaporação do filamento, fazendo com que a lâmpada apresente maior durabilidade, brilho e eficiência.

O isótopo 85Kr, como produto da fissão nuclear do urânio, é utilizado para auxiliar na detecção de bases nucleares clandestinas. Por exemplo, a simples presença desse isótopo no ar, em uma concentração acima do normal, pode indicar uma atividade radioativa.
O principal composto de criptônio, o difluoreto de criptônio (KrF2), pode ser utilizado nas seguintes situações:
-
como laser na produção de dispositivos microeletrônicos;
-
como agente oxidante de grande potencial;
-
como grande doador de íons fluoreto, oxidando a espécie recebedora desses íons, já que o KrF2 é um composto termodinamicamente instável, não podendo ser sintetizado em condições padrões de temperatura e pressão. Assim, graças a esse reagente, é possível a obtenção de metais de transição com altíssimo estado de oxidação, como Ag (III), Au (V), Re (VII) e Os (VIII), e, até mesmo, oxidar o xenônio a maiores estados de oxidação, como +4 e +6.
Não pare agora... Tem mais depois da publicidade ;)
História do criptônio
O nome do elemento 36 vem do grego kryptos, que significa “escondido”. Em 1898, Sir William Ramsey, que já havia descoberto o argônio quatro anos antes com Lord Rayleigh, descobriu o gás criptônio com o auxílio de Morris Travers. Essa descoberta foi motivada pelo fato de a dupla de cientistas ter estado convicta de que outros elementos semelhantes ao argônio existiriam, dando origem a um novo grupo de elementos na Tabela Periódica.
Duas semanas depois, conseguiram também descobrir os gases neônio e xenônio. Todos esses novos gases foram isolados de resíduos da evaporação dos compostos do ar atmosférico liquefeito. Ramsey e Travers conseguiram isolar 25 mililitros de gás criptônio, o qual foi confirmado como um novo elemento através de um espectrômetro. Em 1904, Sir William Ramsey foi laureado com o Prêmio Nobel de Química pelas suas descobertas.
Leia também: Cinco descobertas científicas que aconteceram por acidente
Curiosidades do criptônio
-
Entre 1960 e 1983, o metro padrão foi definido como 1.650.763,73 comprimentos de onda da linha de emissão vermelho-alaranjada (605 nm) do 86Kr. Atualmente, o metro é definido de acordo com a velocidade da luz.
-
Em 1938, o nome do elemento criptônio inspirou o nome do planeta fictício Krypton, lar de Kal-El, conhecido como Clark Kent, o Super-Homem (ou Superman).

Exercícios resolvidos sobre criptônio
Questão 1
O criptônio, como um gás nobre, tem propriedades essenciais para colocá-lo nesse grupo. Dentre elas, podemos destacar:
(A) pertencer ao bloco d da Tabela Periódica.
(B) não se ligar a nenhum átomo, sem possibilidade de formar substâncias compostas.
(C) ter boa estabilidade química na forma de um gás monoatômico.
(D) ter dois elétrons na camada de valência.
(E) ter a maior eletronegatividade de toda Tabela Periódica.
Resposta: letra C
Os gases nobres são marcados pela possibilidade de serem estáveis na forma de um gás monoatômico, ou seja, sem a necessidade de se ligar com outro átomo, como as demais substâncias, simples ou compostas. Por isso, o gabarito é o da letra C.
A letra B fala sobre uma ideia antiga a respeito dos gases nobres de que eles não poderiam formar substâncias compostas. Hoje já se sabe que isso é mentira, pois elementos como Kr e Xe podem se ligar com outros elementos, como o flúor.
Questão 2
Embora ainda se propague erroneamente, por muito tempo se acreditou que os gases nobres não poderiam estabelecer ligações químicas com outros elementos. Um exemplo de substância de gás nobre é o difluoreto de criptônio, KrF2, um poderoso agente oxidante.
Como se sabe, número de oxidação é a carga que o elemento adquire ao estabelecer uma ligação química. Assim, qual a carga adotada pelo criptônio no composto referido?
(A) -4
(B) +4
(C) -2
(D) +2
(E) 0
Resposta: letra D
O flúor possui uma carga fixa igual a -1, assim, pode-se calcular o NOx do Kr pela seguinte equação:
x + 2(-1) = 0
Em que x é a carga do Kr. A equação se iguala a zero, pois se trata de um composto neutro, ou seja, o somatório de cargas positivas e negativas deve ser zero. Resolvendo a equação, temos:
x – 2 = 0
x = +2
Créditos da imagem
Por Stéfano Araújo Novais
Professor de Química

