O potássio, número atômico 19, é um metal extremamente macio e reativo pertencente ao grupo dos metais alcalinos, o grupo 1 da Tabela Periódica. Sua reação com a água e com o gás oxigênio é muito violenta, podendo inclusive produzir explosões. O potássio presente na natureza é formado por três isótopos, sendo que um deles, o de massa 40, é radioativo.
Ele está entre os 10 elementos mais abundantes da crosta terrestre, ocorrendo em uma série de minerais, tais como a silvita e a carnalita. O seu principal uso está na agricultura, por meio da fabricação de fertilizantes, uma vez que o potássio é um macronutriente para os vegetais.
Além disso, o potássio pode ser utilizado na fabricação de fogos de artifício, sabões líquidos e detergentes. Foi descoberto, em 1807, por Sir Humphry Davy, que o isolou por meio de uma eletrólise ígnea.
Veja também: Rubídio — outro elemento químico pertencente ao grupo 1 da Tabela Periódica
Tópicos deste artigo
- 1 - Resumo sobre potássio
- 2 - Propriedades do potássio
- 3 - Características do potássio
- 4 - Onde o potássio pode ser encontrado?
- 5 - Obtenção do potássio
- 6 - Aplicações do potássio
- 7 - Papel biológico do potássio
- 8 - História do potássio
- 9 - Exercícios resolvidos sobre potássio
Resumo sobre potássio
-
O potássio é um metal extremamente macio e reativo pertencente ao grupo dos metais alcalinos.
-
Sua reatividade com o gás oxigênio e com a água é alta, podendo, inclusive, ocasionar explosões.
-
Possui um isótopo natural radioativo, utilizado para a datação de rochas.
-
É o sétimo elemento mais abundante da crosta terrestre.
-
Seu principal minério é a silvita, de fórmula Kcl.
-
Tem importante papel biológico por meio da bomba de sódio e potássio.
-
Seu principal uso é como fertilizante, uma vez que é um macronutriente essencial dos vegetais.
-
Foi isolado, em 1807, por Sir Humphry Davy.
Propriedades do potássio
-
Símbolo: K
-
Número atômico: 19
-
Massa atômica: 39,0983 u.m.a
-
Eletronegatividade: 0,82
-
Ponto de fusão: 63,5 °C
-
Ponto de ebulição: 759 °C
-
Densidade: 0,89 g.cm-3
-
Configuração eletrônica: 4s1
-
Série química: grupo 1, metais alcalinos
Características do potássio

O potássio é um metal muito macio, podendo ser até mesmo cortado com uma faca. Sua coloração é acinzentada e possui um brilho característico metálico, porém tal aparência não dura muito tempo, já que o potássio é extremamente reativo com o oxigênio e a umidade presente no ar. Por isso, ele deve ser acondicionado em um óleo mineral, de modo que não fique exposto ao ar atmosférico.
Assim como os demais metais alcalinos, a reação do potássio com a água é bastante exotérmica, podendo causar acidentes e até mesmo explosões.
2 K (s) + H2O (l) → 2 KOH (aq) + H2 (g)
Por isso, a manipulação de potássio metálico em um laboratório deve ser feita de maneira rigorosa, evitando utilizar quantidades maiores do que o necessário. Além disso, os metais alcalinos também podem reagir com halogênios (grupo 17) e gás hidrogênio quando aquecidos, assim, as reações para o potássio são:
-
2 K + X2 → 2 KX (X = halogênio)
-
2 K + H2 → 2 KH
Um composto de potássio pode ser identificado qualitativamente por meio do teste de chama. Uma das formas de se fazer isso é dissolvendo-o em ácido clorídrico concentrado, gerando um cloreto volátil, e então colocando-o sob a ação de uma intensa chama (de um bico de Bunsen, por exemplo). Os compostos de potássio apresentam coloração lilás.
São conhecidos 21 isótopos de potássio, contudo, o potássio natural apresenta apenas três isótopos. Entre estes, há um isótopo radioativo, o 40K, cujo tempo de meia-vida é de 1,26 x 109 anos (1,26 bilhão de anos), o que corresponde a 0,0117% de todo potássio natural existente. Por mais irônico que pareça, o potássio-40 torna o corpo humano naturalmente radioativo, embora com níveis irrisórios. O 40K, ao sofrer decaimento beta, transmuta-se para o isótopo 40Ar:
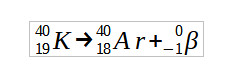
Essa transmutação é a base para a técnica de datação de minerais, como biotita, horneblenda e rochas vulcânicas, pois, quando o magma vulcânico se resfria, o 40Ar (decorrente da transmutação do 40K) fica aprisionado na rocha. Ao se liberar o argônio, é possível quantificar sua massa. Depois, a quantidade de potássio remanescente é também quantificada, e, daí, é possível datar o mineral por meio da relação entre 40K e 40Ar.
Onde o potássio pode ser encontrado?

O potássio compõe 2,4% da massa da crosta terrestre, sendo o sétimo elemento mais abundante que existe. Embora tenha grande presença, o potássio não ocorre em sua forma elementar, estando, na maior parte das vezes, misturado a outros elementos químicos, como o sódio.
A tabela a seguir traz os principais minérios de potássio, bem como sua fórmula molecular e sua concentração, nas formas de K2O e K. No linguajar da mineração, é muito comum unificar os produtos que contêm potássio em “percentual equivalente de K2O”.
Antigamente, o termo potassa também era bastante utilizado para designar compostos de potássio, contudo, ele apresenta ambiguidade e, por isso, vem sendo descontinuado. É possível converter o percentual equivalente de K2O em percentual equivalente de K por meio da seguinte expressão matemática:
K2Oequivalente * 0,83016 = K
|
Principais minérios do potássio |
|||
|
Mineral |
Fórmula molecular |
Percentual equivalente (%) |
|
|
K2O |
K |
||
|
Silvita |
KCl |
63,17 |
52,44 |
|
Carnalita |
KMgCl3•6H2O |
16,95 |
14,07 |
|
Cainita |
KCl.MgSO4•3H2O |
19,26 |
15,71 |
|
Langbeinita |
K2Mg2(SO4)3 |
22,69 |
18,84 |
|
Polialita |
K2MgCa2(SO4)4•2H2O |
15,62 |
12,97 |
|
Arcanita |
K2SO4 |
54,06 |
44,88 |
|
Glaserita |
K6Na2(SO4)4 |
42,51 |
35,29 |
Os minerais solúveis de potássio também podem estar presentes na salmoura e nos oceanos, embora o teor de potássio nos oceanos seja bem menor que do sódio. Outra fonte rochosa de potássio é o sal-gema, uma mistura de cloreto de sódio, cloreto de potássio e cloreto de magnésio.
Entre os países com maiores fontes naturais de minerais de potássio, estão:
-
Canadá (com mais de 1 milhão de toneladas de K2O equivalente);
O Brasil possui cerca de 2300 toneladas de K2O equivalente. Israel e Jordânia fazem extração de compostos de potássio no mar Morto, o qual contém cerca de dois bilhões de toneladas de cloreto de potássio. Não à toa esses dois países foram, respectivamente, os sexto e sétimo maiores produtores de compostos de potássio em 2020.
Saiba mais: Ferro — o quarto elemento químico mais abundante na crosta terrestre
Obtenção do potássio
O potássio ainda é obtido da mesma forma que o foi pela primeira vez: por meio da eletrólise ígnea, ou seja, sem a presença de água. Atualmente, o composto de potássio mais utilizado para a eletrólise é o cloreto de potássio, KCl, mas o hidróxido de potássio, KOH, também já foi muito utilizado. Na eletrólise, o potássio fundido é obtido no cátodo, enquanto o contraíon negativo é oxidado no ânodo.
Contudo, há uma técnica mais moderna para a obtenção de potássio metálico. Como o sódio é um elemento de maior potencial de redução que o potássio, é possível passar uma corrente de sódio vaporizado, a cerca de 850 °C, contra um fluxo de KCl fundido em uma torre de fracionamento. Isso produzirá uma liga Na–K, em que o potássio pode ser separado do sódio por meio de uma destilação. Estima-se que o potássio produzido alcance uma pureza de 99,5%.
Interessante: Atualmente, a grama do potássio com 98% de pureza está custando R$ 20,74, enquanto a grama do potássio com 99,5% de pureza está custando R$ 35,60.
Aplicações do potássio
A grande utilização do potássio está no campo dos fertilizantes. Estima-se que 95% da produção de potássio e seus compostos são destinados para esse fim. Com nitrogênio e fósforo, o potássio é um macronutriente essencial para os vegetais, pois interage em quase todos os processos metabólicos deles. O potássio, com nitrogênio e fósforo, compõe o grupo dos macronutrientes essenciais dos vegetais, os chamados NPK.
Embora os solos sejam ricos em potássio, com mais de centenas ou, até mesmo, milhares de quilos de potássio por hectare, pouco desse potássio está disponível para as plantas em todo seu período de desenvolvimento.
Estima-se que apenas 2% do potássio presente no solo estão disponíveis para as plantas. Isso porque boa parte do potássio está presente em rochas e minerais pouco ou muito pouco solúveis, ou capturado entre as camadas formadoras do solo. Assim, o único potássio disponível é aquele que está solúvel, seja no solo, seja em corpos hídricos.
Porém a escolha do fertilizante de potássio ideal e sua forma de aplicação devem ser baseadas nas condições e demandas do solo e da cultura a ser plantada bem como no seu preço e disponibilidade. Entre os fertilizantes de potássio mais usados estão o cloreto de potássio, KCl, e o sulfato de potássio, K2SO4.
Para pessoas hipertensas, o cloreto de potássio é uma boa alternativa para o tradicional sal de cozinha, o cloreto de sódio. No mercado, é possível encontrar misturas de ambos, conhecidas como sal light, que, no entanto, acaba tendo um preço de mercado muito maior que o sal de cozinha convencional.
O cloreto de potássio é também utilizado na injeção letal para execuções de penas de morte. O prisioneiro sofre, no primeiro momento, uma parada cardíaca e então falece poucos minutos depois. Também pode ser utilizado na eutanásia de animais, porém, por ser extremamente doloroso, a aplicação, tanto em prisioneiros quanto em animais, deve ser precedida por anestesia adequada.
O superóxido de potássio, KO2, pode ser utilizado em respiradores (máscaras de respiração). Isso porque o KO2 absorve a água, produzindo O2 para respiração e também hidróxido de potássio, KOH, o qual absorve o CO2 exalado, conforme as reações a seguir:
-
2 KO2 + 2 H2O → 2 KOH + H2O2 + O2
-
KOH + CO2 → KHCO3
A liga Na–K é empregada como fluido de transferência de calor para o resfriamento de reatores nucleares. Já o hidróxido de potássio, KOH, tem papel fundamental na preparação de diversos sais que fazem parte da constituição de detergentes e sabões líquidos, porém com custo mais alto que aqueles que utilizam sais de sódio.
Sais de potássio, como o carbonato e o nitrato, também podem ser usados na fabricação de fogos de artifício, promovendo a coloração púrpura característica do seu teste de chama.
Leia também: Cobalto — outro elemento químico que possui várias aplicações
Papel biológico do potássio
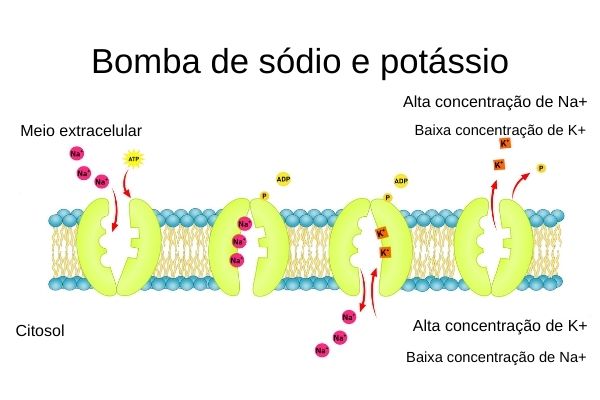
Sódio e potássio estão envolvidos em várias funções eletrofisiológicas em animais com características avançadas e desenvolvidas, como mamíferos e outros vertebrados, sendo fundamental para que ocorra o adequado funcionamento das células.
A proporção entre os íons Na+ e K+ dentro e fora das células é diferente. Em condições normais, a concentração de Na+ é menor dentro da célula (citosol) e maior fora dela, enquanto, também em condições normais, a concentração de K+ é maior dentro da célula e menor fora dela
Contudo, deve-se entender que, se nada for feito, os íons igualarão suas concentrações nos ambientes intra e extracelular por meio da difusão. Isso não é interessante, pois o gradiente de concentração não só é essencial para o funcionamento do metabolismo, como também é responsável pela transmissão de impulsos nervosos e contração muscular.
Por isso, existe um mecanismo de transporte ativo de nosso corpo chamado de bomba de sódio e potássio, em que se utiliza energia (adenosina trifosfato, ATP) para que o gradiente de concentração seja mantido, evitando o processo espontâneo da difusão.
Outro elemento muito importante são os receptores de íons Na+ e K+ na membrana plasmática, as chamadas proteínas transmembranas. A alta afinidade entre essas proteínas e os íons permite a captura destes no fluido celular, facilitando o controle do gradiente de concentração.
O ATP também se liga à proteína, liberando um grupo fosfato e se transformando em ADP (adenosina difosfato). É esse fosfato que causa uma alteração conformacional (espacial) na proteína capaz de liberar os íons sódio aprisionados por ela.
História do potássio
O potássio foi isolado, em 1807, por Sir Humphry Davy, por meio da eletrólise ígnea do hidróxido de potássio fundido. Essa, inclusive, foi a primeira vez na história da humanidade que um metal foi isolado por meio da eletrólise.
Um ano depois, tendo começado a estudar o metal, o francês Louis Joseph Gay-Lussac percebeu a grande reatividade do metal purificado, com isso ocorrendo da pior forma possível: por meio de uma explosão, a qual o deixou com problemas de visão pelo resto de sua vida.
O elemento potássio pode ser também conhecido como kalium, de onde seu símbolo, K, é derivado. Tal nome tem origem no composto K2CO3, o carbonato de potássio, denominado potassa na Antiguidade (daí o nome potássio) ou também al-qalyah, em árabe, o que significa “al-calino”. A palavra árabe originou a palavra latina kalium.
Exercícios resolvidos sobre potássio
Questão 1
“Vale suspende projeto de potássio Rio Colorado, na Argentina
Projeto voltado para mercado de fertilizantes está orçado em US$ 5,9 bi.” (G1, 2013)
A notícia publicada trata de um projeto de mineração de potássio. Sobre esse elemento, analise as afirmativas a seguir:
1. É um metal.
2. Soluções salinas de seus haletos costumam ser levemente alcalinas.
3. Na mineração, é extraído como substância simples de águas de lagos e rios.
4. Sua principal aplicação é em fertilizantes, sendo o terceiro macronutriente da sigla NPK.
Assinale a alternativa correta.
A) Somente a afirmativa 1 é verdadeira.
B) Somente as afirmativas 2 e 3 são verdadeiras.
C) Somente as afirmativas 2, 3 e 4 são verdadeiras.
D) Somente as afirmativas 1 e 4 são verdadeiras.
E) Somente as afirmativas 1, 3 e 4 são verdadeiras.
Resolução:
Alternativa D
1. É um metal. (verdadeira)
O potássio é um metal alcalino, logo, a primeira afirmativa está correta.
2. Soluções salinas de seus haletos costumam ser levemente alcalinas. (falsa)
Quanto à alcalinidade de suas soluções salinas, isso não é sempre verdade. O potássio é um eletrólito forte, ou seja, não sofre hidrólise, não consumindo os íons OH- presentes na solução. Os haletos, excetuando-se o flúor, são todos eletrólitos fortes também, indicando que a solução salina entre potássio e cloro, bromo ou iodo é neutra (não há consumo nem de íons hidróxido, nem de íons hidrônio). Assim, a segunda afirmativa não é verdadeira.
3. Na mineração, é extraído como substância simples de águas de lagos e rios. (falsa)
Embora possa ser extraído de águas de lagos e rios, o potássio não é extraído na forma simples, mas sim composta, na forma de sais obtidos após evaporação do corpo hídrico. Assim, a terceira afirmativa não está correta também.
4. Sua principal aplicação é em fertilizantes, sendo o terceiro macronutriente da sigla NPK. (verdadeira)
Quanto à afirmativa 4, o potássio é sim amplamente utilizado em fertilizantes, sendo o “K” da sigla NPK. Assim, a afirmativa 4 está correta.
Questão 2
(IFSP) O cloreto de potássio, KCl, vem sendo utilizado no chamado sal light, substituindo parte do cloreto de sódio que constitui o sal comum. Sabendo que o potássio é um elemento do grupo 1 da Tabela Periódica (metal alcalino) e que o cloro é um elemento do grupo 17 (halogênio), pode-se afirmar que as ligações químicas existentes nos cristais de cloreto de potássio são
A) iônicas.
B) metálicas.
C) covalentes simples.
D) covalentes duplas.
E) covalentes triplas.
Resolução:
Alternativa A
O potássio é um metal alcalino cuja eletronegatividade é de 0,82. Já o cloro é um ametal cuja eletronegatividade é de 3,16. Com isso, podemos concluir que o KCl se trata de um composto de ligações iônicas, não só porque é formado por um metal e um ametal, mas também porque a diferença de eletronegatividade (3,16 – 0,82) é maior do que 1,7.
Por Stéfano Araújo Novais
Professor de Química

