O fósforo, símbolo P, foi o primeiro elemento químico isolado pelo ser humano, em 1669, pelo alquimista alemão Henning Brand, por meio de um resíduo obtido da evaporação da urina. Em sua forma pura, é semitransparente, com uma consistência semelhante à da cera de abelha. Brilha no escuro (fosforesce) e também pega fogo espontaneamente em contato com o ar.
O fósforo apresenta pelo menos 10 variedades alotrópicas, as quais podem ser divididas em branca, vermelha, e preta, sendo o alótropo P4 (branco) o primeiro a ser descoberto. É um macronutriente essencial para o solo, junto ao nitrogênio e potássio (conhecidos como NPK). Está presente na constituição do DNA, nos dentes, nos ossos, além de ser parte constituinte da molécula de adenosina trifosfato (ATP), nossa principal fonte de energia química.
Leia também: Rubídio – elemento químico que reage violentamente à água
Tópicos deste artigo
- 1 - Resumo sobre o fósforo
- 2 - Propriedades do fósforo
- 3 - Características do fósforo
- 4 - Aplicações do fósforo
- 5 - Importância do fósforo
- 6 - Precauções com o fósforo
- 7 - História do fósforo
- 8 - Ciclo do fósforo
- 9 - Exercícios resolvidos sobre fósforo
Resumo sobre o fósforo
-
O fósforo é um ametal do terceiro período da Tabela Periódica, localizado no grupo 15.
-
O fósforo possui diversas formas alotrópicas, classificadas em branca, vermelha e preta.
-
O alótropo P4, branco, é considerado a forma padrão.
-
O P4 tem aparência de cera de abelha, é altamente tóxico, entra em combustão espontânea em contato com o ar, é muito reativo e fosforesce.
Não pare agora... Tem mais depois da publicidade ;) -
Os demais alótropos (vermelho e preto) diferem-se em propriedades físicas (cor) e químicas (reatividade, luminescência e toxicidade).
-
O fósforo é amplamente utilizado em fertilizantes e na fabricação de caixas de fósforo.
-
O ácido fosfórico é utilizado como acidulante de bebidas refrigerantes.
-
O fósforo branco e compostos organofosforados são perigosos e já foram usados como armas químicas.
-
O ciclo do fósforo é de grande importância para a manutenção da vida no planeta.
Propriedades do fósforo
-
Símbolo: P
Não pare agora... Tem mais depois da publicidade ;) -
Número atômico: 15
-
Massa atômica: 30,9 u
-
Isótopo natural: 31P (≈100%)
-
Ponto de fusão: 44,1 °C (branco)
-
Ponto de ebulição: 280 °C (branco)
-
Densidade: 1,823 g.cm-3
Não pare agora... Tem mais depois da publicidade ;) -
Eletronegatividade: 2,19
-
Configuração eletrônica: [Ne]3s23p3
-
Localização na Tabela Periódica: grupo 15, 3º período (ametal)
Características do fósforo

O fósforo é um ametal que apresenta 10 variações alotrópicas (embora alguns autores citem a existência de 11 ou até mesmo 12 variações), divididas entre as categorias branca, preta e vermelha.
O fósforo branco, na forma do alótropo P4, de geometria tetraédrica, foi a primeira forma pura de fósforo a ser isolada e é também considerado a forma padrão.
De aspecto semitransparente, mole, com consistência que remete à cera de abelha, essa substância é pirofórica, ou seja, tem a propriedade de entrar em combustão espontaneamente em contato com o ar. Por isso, deve sempre ser acondicionada em materiais inertes para que não entre em combustão.
A variação branca, ao ser exposta à luz, adquire uma coloração amarelada. É também muito tóxica, sendo rapidamente absorvida pelo sangue e pulmões. Praticamente insolúvel em água, mas com boa solubilidade em benzeno e outros solventes apolares, como CS2 e PCl3.
Com quantidades controladas de oxigênio, o P4 sofre uma oxidação quimioluminescente, emitindo um brilho verde e formando lentamente o P4O8, além de um resíduo de O3. O fósforo branco também tem capacidade de brilhar no escuro (fosforesce).
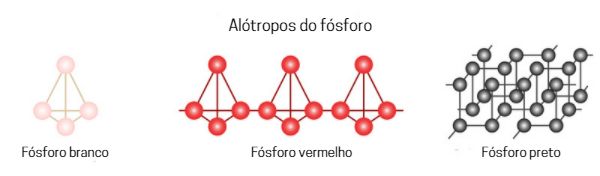
Os alótropos de fósforo dentro da categoria vermelha apresentam diversas formas cristalinas complexas, sendo a variação de Hittorf (ou violeta) uma das formas mais bem caracterizadas.
Basicamente, a variação alotrópica vermelha apresenta uma estrutura com cadeias interligadas, derivada do P4. É atóxica, não fosforesce, é menos reativa que a variação branca e também menos inflamável. Contudo, entra em combustão espontânea em contato com o ar em temperaturas acima de 520 K. Pode ser sintetizada do aquecimento da forma branca em atmosfera inerte em uma temperatura de 540 K.
Já a variação preta apresenta a maior estabilidade, sendo considerada quimicamente inerte. Não é tóxica e também não apresenta propriedade pirofórica, sendo obtida pelo aquecimento da variação branca em pressões elevadas. É similar ao grafite quanto a estrutura e propriedades, como a cor e sua condutividade elétrica.
Veja também: Chumbo – metal tóxico e bioacumulativo
Aplicações do fósforo
O fósforo é o 11º elemento mais abundante da crosta terrestre, por conta dos minerais fosfatados, como a apatita, a wavelita, a vivianita e a fosforita (ou rocha fosfatada), sendo esta última a de maior interesse comercial.
Por meio dos minérios fosfatados, é possível produzir o superfosfato e muitos outros adubos e fertilizantes fosfatados, amplamente utilizados na agricultura. Vale lembrar que, em conjunto com o potássio e o nitrogênio, o fósforo é um macronutriente para as plantas, ou seja, elemento que a planta precisa em grande quantidade para seu pleno desenvolvimento, auxiliando na formação de flores e frutos saudáveis.

Os palitos de fósforo, de grande utilização por nossa sociedade, foram inicialmente desenvolvidos por John Walker, um farmacêutico inglês, em 1827. Contudo, Walker decidiu não patentear seu invento, querendo que tal conhecimento fosse de bem público, o que permitiu cópias. Samuel Jones, então, passou a vender os palitos sob a marca Lucifers, que logo se popularizou.
Contudo, por ser feito com fósforo branco, tal produto foi proibido mundialmente durante os primeiros 20 anos do século XX, afinal, um incêndio poderia ocorrer facilmente com seu uso. A alteração do fósforo branco para o vermelho nos palitos ocorreu ainda no século XIX, trazendo mais segurança, pois, além dessa variação ser menos inflamável, os materiais inflamáveis não tinham contato com ela, sendo separados na cabeça e nas paredes externas da caixa.
Atualmente, os palitos de fósforo não possuem mais fósforo, sendo feitos de enxofre, oxidantes e cola. O único resquício de fósforo está na lixa contida na parte externa das caixas, com trissulfeto de antimônio e dextrina, garantindo maior segurança no uso do palito.
![Coleção de antigas caixas de fósforo tailandesas, em Bangkok.[1]](https://s5.static.brasilescola.uol.com.br/be/2021/09/caixa-fosforo.jpg)
Na forma de seu principal ácido, o ácido fosfórico (H3PO4) é utilizado como acidulantes em bebidas refrigerantes. Os acidulantes regulam a doçura do açúcar (excessivo nessas bebidas), realçam o paladar e mantêm o pH da bebida baixo (entre 2,7 e 3,5), o que não permite a proliferação de microrganismos. O ácido fosfórico é rotulado comercialmente como INS 338, e, apesar de quimicamente ser considerado um ácido fraco, é o de maior acidez entre todos os utilizados em bebidas, principalmente nos refrigerantes de cola.
Alguns fosfatos sintéticos também são utilizados na fabricação de detergentes e outros produtos de limpeza, pois são bons emulsionantes de gordura e graxa.
Confira no nosso podcast: A química dos agrotóxicos
Importância do fósforo
Uma das principais formas aniônicas do fósforo, o fosfato (PO43-) é um nutriente essencial para todos os organismos vivos. O fosfato está na espinha dorsal das moléculas do DNA, o ácido desoxirribonucleico, assim como nas moléculas de ATP (adenosina trifosfato), as quais transportam energia entre as células. A hidroxiapatita, Ca5(PO4)3OH, é o principal constituinte inorgânico de nossos dentes e ossos.
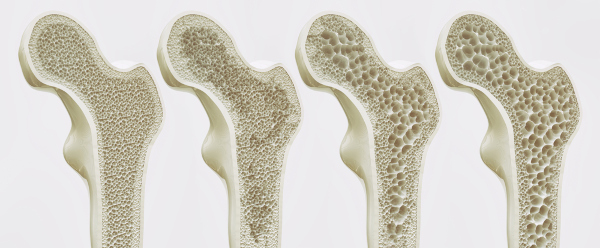
Essencial à nossa nutrição, o fósforo pode ser obtido, por vias alimentares, através de ácido fítico, fosfolipídeos, ácidos nucleicos e outros compostos, quando a alimentação fornecida for à base de vegetais. Cerca de 70% do fósforo absorvido pelo nosso organismo são destinados aos ossos, enquanto o restante é usado para metabolizar açúcares e gorduras. Na infância, a deficiência de fósforo leva a uma má dentição e causa também raquitismo (doença que deixa os ossos fracos e envergados). Em adultos, a deficiência de fósforo pode levar à osteoporose, doença que causa perda progressiva de massa óssea, deixando os ossos enfraquecidos e predispostos a fraturas.
Os organofosforados foram importantes durante a Revolução Verde, da década de 1960, período em que foram utilizadas novas sementes e técnicas agrícolas, culminando em um aumento da produção agrícola. Tais compostos se mostraram mais tóxicos para as pragas do que para os seres humanos, daí então surgiram o glifosato (comercialmente vendido como RoundUp), agrotóxico mais vendido do mundo, e o malation.
Precauções com o fósforo
O fósforo branco, como antes citado, é bastante tóxico, tão tóxico quanto o cianeto. Condições precárias de trabalho do século XIX levavam operários à longa exposição a esse composto, causando uma doença chamada de phossy jaw (traduzida como “mandíbula de fósforo”), uma necrose de fósforo na mandíbula que, além de muito dolorosa, deforma essa parte do corpo substancialmente. Tal doença ajudou no impulsionamento de importantes discussões acerca das condições de saúde e segurança do trabalhador e de seus direitos.
A toxicidade e a inflamabilidade do P4 também o transformaram em uma terrível arma química. Durante a Segunda Guerra Mundial, ambos os lados lançaram toneladas de P4 sobre as cidades rivais em bombas incendiárias que deixavam rastros luminosos do fósforo líquido queimado.
A queimadura por fósforo é dolorosa, queimando não só a pele mas também a carne humana. Além disso, o anidrido fosfórico (P4O10), produzido durante a queima, rapidamente se hidrolisa para ácido fosfórico, causando queimaduras ácidas. Mesmo com tamanho estrago, o fósforo branco não é considerado arma química pela Convenção sobre Armas Químicas.
Organofosfatos também têm ampla utilização como armas químicas, sendo os mais conhecidos o tabun, o sarin e o soman. Inicialmente desenvolvidos com fins de pesticida, tais compostos se mostraram extremamente tóxicos, sendo então incorporados por forças de guerra como agentes neurotóxicos desde a Segunda Guerra Mundial.
Os fertilizantes organofosforados também são uma pauta constante no debate ambiental. Com a alta demanda desses agentes, ambientalistas temem os efeitos nocivos que eles possam causar no balanço natural de corpos d’água. O fosfato desses fertilizantes que chegam aos lagos contribui para a eutrofização (aumento excessivo do crescimento de algas), cuja presença diminui a quantidade de O2 disponível, afetando, assim, peixes e demais animais presentes.

O glifosato, por exemplo, foi classificado como provável causador de câncer pela Agência Internacional para Pesquisa do Câncer (Iarc), ligada à Organização Mundial da Saúde (OMS), em 2015. A agência reguladora europeia EFSA considerou o glifosato seguro para a saúde humana, desde que em níveis pequenos e controlados.
No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa) iniciou uma avaliação em 2008, e concluiu que o glifosato não apresenta características mutagênicas ou carcinogênicas. Contudo, apesar da discussão, sabe-se que os níveis de agrotóxico permitidos no Brasil são superiores aos dos demais países, em geral.
Leia também: Boro – elemento químico pouco reativo
História do fósforo
Apesar de outros elementos nativos já serem de conhecido do ser humano desde a Antiguidade, como o ouro e a prata, o fósforo é considerado o primeiro elemento a ser descoberto pelo homem. Isso porque o ouro e a prata já eram encontrados na sua forma pura, enquanto o fósforo necessitou ser isolado de uma mistura.
Foi preparado pela primeira vez, em 1669, pelo alquimista alemão Henning Brand. Sua busca pela pedra filosofal o levou a aquecer resíduos sólidos de urina em um forno. Brand então obteve um composto branco amarelado, com propriedades luminescentes e emitindo luz sem chama ou calor.
Apenas em 1974 foi constatado que as espécies brilhantes eram produtos intermediários de oxidação (HPO e P2O2), os quais se formavam na superfície do P4.
Ciclo do fósforo
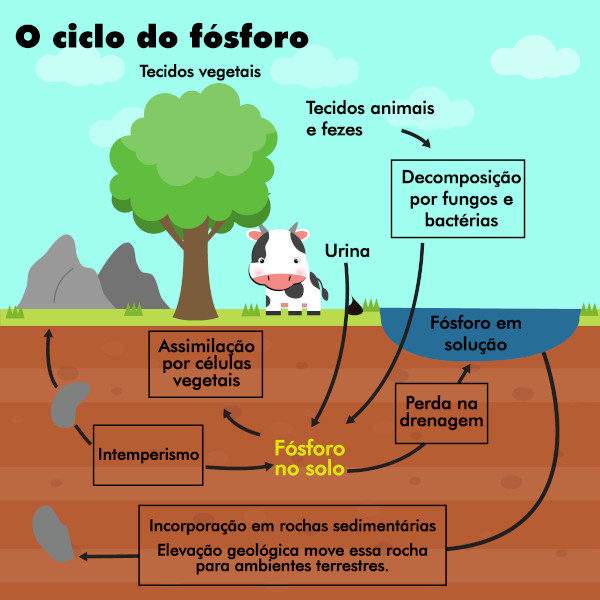
O fósforo também possui um ciclo biogeoquímico, de extrema importância para a manutenção da vida no planeta. Os compostos de fósforo, como citado, são diversos e estão presentes por conta de diversas moléculas essenciais.
Os grandes reservatórios de fósforo são minerais, ou seja, rochas e outros depósitos que foram se formando ao longo das eras geológicas. Por ação do intemperismo — processos químicos e físicos de desintegração, degradação ou decomposição de rochas —, o fósforo é liberado para o meio ambiente.
No meio ambiente, então, ele é absorvido pelas plantas e chega a outros seres vivos por meio da cadeia alimentar. Os seres vivos retornam o fósforo por meio de urina, fezes e também por sua decomposição após a morte. Os fertilizantes também atuam no ciclo do fósforo, pois são carregados para corpos d’água após sua utilização.
Exercícios resolvidos sobre fósforo
Questão 1 - (Enem) O fósforo, geralmente representado pelo íon de fosfato (PO43−), é um ingrediente insubstituível da vida, já que é parte constituinte das membranas celulares e das moléculas do DNA e do trifosfato de adenosina (ATP), principal forma de armazenamento de energia das células. O fósforo utilizado nos fertilizantes agrícolas é extraído de minas, cujas reservas estão cada vez mais escassas. Certas práticas agrícolas aceleram a erosão do solo, provocando o transporte de fósforo para sistemas aquáticos, que fica imobilizado nas rochas. Ainda, a colheita das lavouras e o transporte dos restos alimentares para os lixões diminuem a disponibilidade dos íons no solo. Tais fatores têm ameaçado a sustentabilidade desse íon.
Uma medida que amenizaria esse problema seria:
A) Incentivar a reciclagem de resíduos biológicos, utilizando dejetos animais e restos de culturas para produção de adubo.
B) Repor o estoque retirado das minas com um íon sintético de fósforo para garantir o abastecimento da indústria de fertilizantes.
C) Aumentar a importação de íons fosfato dos países ricos para suprir as exigências das indústrias nacionais de fertilizantes.
D) Substituir o fósforo dos fertilizantes por outro elemento com a mesma função para suprir as necessidades do uso de seus íons.
E) Proibir, por meio de lei federal, o uso de fertilizantes com fósforo pelos agricultores, para diminuir sua extração das reservas naturais.
Resolução
Alternativa A. A reciclagem permite sanar o problema ao evitar a extração mineral do fósforo, grande preocupação apresentada pela questão.
A reposição com íons sintéticos não se mostra viável diante da grande demanda desse produto, nem diminui o ritmo de exploração mineral. Da mesma forma, importação de íons fosfatos acarretaria em maior custo e não diminuiria os problemas da exploração mineral. A substituição do fósforo por outro elemento poderia afetar o ciclo do fósforo e não trazer os mesmos resultados esperados, assim como a proibição por lei desses fertilizantes impactaria significativamente a cadeia produtiva de alimentos no país, além da renda de diversos agricultores.
Questão 2 - (Uece) Conforme a publicação Science et Vie de outubro de 2010, o pesquisador Charles Bristow de La Birbeck, da Universidade de Londres, descobriu sedimentos ricos em fósforo e ferro presentes em um lago seco no Saara. Durante o inverno, esses sedimentos são transportados pelos ventos, que depositam 80% deles no oceano, e 20%, cerca de 30.000 toneladas, chegam até a Floresta Amazônica, fertilizando seu solo pobre em nutrientes.
Sobre o fósforo, marque a afirmação FALSA
A) Oxida-se espontaneamente em contato com o oxigênio do ar atmosférico, emitindo luz (fenômeno da fosforescência).
B) É considerado um elemento químico essencial e tem relevante papel na formação molecular do DNA e do RNA, bem como da ATP.
C) O ácido fosfórico ou ortofosfórico, utilizado na produção de refrigerantes, detergentes e chocolates, é considerado um ácido fraco.
D) Fósforo branco e fósforo vermelho são espécies químicas que diferem entre si apenas pelas propriedades físicas e pela coloração.
Resolução
Alternativa D. Os fósforos branco e vermelho não diferem apenas na cor ou em outras propriedades físicas mas também em propriedades químicas. O fósforo branco é extremamente tóxico e pirofórico, além de ser muito reativo.
Já o fósforo vermelho é menos pirofórico, menos reativo e é atóxico, além de não fosforescer.
Crédito da imagem
[1] Nuntiya / Shutterstock
Por Stéfano Araújo Novais
Professor de Química

