Ligação iônica é um dos três tipos de interação entre dois átomos (as outras ligações são a covalente e a metálica). Na ligação iônica, um dos átomos é obrigatoriamente um metal, e o outro, um ametal ou o hidrogênio.
Os princípios que fundamentam uma ligação iônica são apenas dois: a perda de elétrons por um átomo (de caráter metálico elevado) e o ganho desses elétrons por outro átomo (de caráter ametálico elevado).
Veja também: O que é camada de valência?
Tópicos deste artigo
- 1 - Cargas dos elementos de cada família
- 2 - Íon-fórmula
- 3 - Exemplo
- 4 - Fórmula eletrônica de Lewis
- 5 - Características dos compostos iônicos (substâncias formadas a partir da ligação iônica)
Cargas dos elementos de cada família
As cargas dos átomos seguem o princípio da teoria do octeto: para atingir a estabilidade, o átomo precisa ter oito elétrons em sua camada de valência.
No caso dos metais, essa estabilidade é atingida pela perda de elétrons; já nos ametais, ocorre por meio do ganho de elétrons.
-
Família dos metais alcalinos (possuem 1 elétron na camada de valência) = carga +1;
-
Família dos metais alcalinoterrosos (possuem 2 elétrons na camada de valência) = carga +2;
-
Família do boro (possuem 3 elétrons na camada de valência) = se metal, carga +3; se ametal, carga -3;
-
Família do carbono (possuem 4 elétrons na camada de valência) = se metal, carga +3; se ametal, carga -3;
-
Família do nitrogênio (possuem 5 elétrons na camada de valência) = se metal, carga +5; se ametal, carga -3;
-
Família dos calcogênios (possuem 6 elétrons na camada de valência) = se metal, carga +6; se ametal, carga -2;
-
Família dos halogênios (possuem 7 elétrons na camada de valência) = carga -1.
Veja também: Exceções à regra do octeto
Íon-fórmula
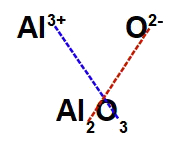
A fórmula de uma substância formada por ligação iônica é denominada íon-fórmula, a qual é construída a partir do cruzamento das cargas do metal e do ametal (ou do hidrogênio). Nesse cruzamento, a carga de um transforma-se no índice atômico (quantidade de átomos) do outro.
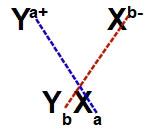
Representação do cruzamento para formação do íon-fórmula de um composto iônico
Exemplo
Veja como fica o íon-fórmula da substância iônica que apresenta alumínio (sigla Al) e oxigênio (sigla O):
-
O alumínio é um metal que pertence à família do boro, ou seja, apresenta carga +3;
-
O oxigênio é um ametal que pertence à família dos calcogênios, ou seja, possui carga -2;
Fórmula eletrônica de Lewis
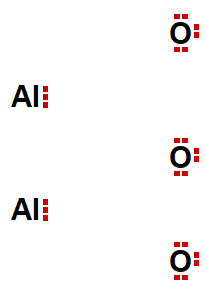
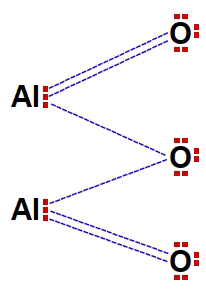
A fórmula eletrônica de Lewis demonstra a ligação iônica entre dois ou mais átomos, ou seja, indica a perda e o ganho de elétrons (representados por esferas) entre eles. Nela colocamos os elétrons da camada de valência de cada elemento envolvido.
Vamos considerar o exemplo anterior. Nesse caso, o alumínio (posicionado à esquerda) apresenta 3 elétrons (família do boro), e o oxigênio (à direita) apresenta 6 elétrons (família dos calcogênios). Os elétrons podem ser posicionados em cima, embaixo, à direita ou à esquerda da sigla do elemento. No metal, sempre estão no lado direito da sigla. Já no ametal, o lado esquerdo, de preferência, deve ficar sem elétrons:
O ganho e a perda de elétrons são representados por uma seta que sai do elétron do metal até o lado esquerdo (vazio) da sigla do ametal:
Características dos compostos iônicos (substâncias formadas a partir da ligação iônica)
-
Sólidos à temperatura ambiente;
-
Ponto de fusão e de ebulição mais elevados que os dos compostos moleculares;
-
São polares;
-
Sofrem dissociação quando dissolvidos em água;
-
Conduzem corrente elétrica se dissolvidos em água ou quando no estado líquido (após passarem pelo processo de fusão);
-
De forma geral, são solúveis em água.
Por Me. Diogo Lopes