O ferro é o metal mais utilizado no mundo, sendo conhecido há milhares de anos. Sua utilização é tão extensa que existe um campo da metalurgia só para estudar a produção de ferro e seus compostos: a siderurgia. Do ferro se faz o aço, a liga metálica mais utilizada no planeta. É a principal substância metálica produzida no Brasil, tendo uma participação superior a 70% no valor total de produção de metais.
O ferro tem usos diversos, na formação de ligas metálicas, em utensílios industriais e domésticos, na produção de automóveis, pontes, estruturas metálicas de edifício, cascos de navios, pregos, parafusos, alicantes, entre outras diversas ferramentas. Sua versatilidade e ampla utilização se devem ao seu baixo custo, alta disponibilidade e boa resistência mecânica.
Leia também: Rubídio – metal alcalino que reage violentamente com a água
Tópicos deste artigo
- 1 - Resumo sobre o ferro
- 2 - Propriedades do ferro
- 3 - Características do ferro
- 4 - Obtenção do ferro
- 5 - Aplicações do ferro
- 6 - História do ferro
- 7 - Exercícios resolvidos sobre o ferro
Resumo sobre o ferro
-
É o metal mais utilizado no mundo.
-
O aço é uma liga metálica feita do ferro com pequenos teores de carbono.
-
Os principais minérios de ferro são a hematita, a goethita e a magnetita.
-
O ferro metálico pode ser obtido por meio de reações de oxirredução com monóxido de carbono.
-
É a principal substância metálica produzida no Brasil.
-
É constituinte de diversos utensílios de uso doméstico e industrial.
-
Está presente na hemoglobina e mioglobina, sendo importante para sistemas biológicos.
-
Seu uso se iniciou na Antiguidade, há cerca de 5000 anos.
Propriedades do ferro
-
Número atômico: 26
-
Massa molar: 55,85 g/mol
-
Isótopos naturais: 56Fe (91,75%), 54Fe (5,85%), 57Fe (2,12%) e 58Fe (0,28%)
-
Ponto de fusão: 1535 °C
-
Ponto de ebulição: 2862 °C
-
Densidade: 7,8 g/mL
-
Localização na Tabela Periódica: grupo 8, 4º período
-
Distribuição eletrônica: 4s23d6

Características do ferro
O ferro é o quarto elemento mais abundante da crosta terrestre, com cerca de 5% em massa, sendo o segundo metal mais abundante (ficando atrás apenas do alumínio). Sua grande disponibilidade é apenas uma das vantagens de tal elemento, sendo suas propriedades mecânicas e o seu baixo custo as demais.
É um metal maleável, ou seja, pode ser facilmente dobrado, laminado, forjado e conformado, e de grande resistência mecânica. É também um material fortemente magnético, e, por conta disso, os materiais com propriedades semelhantes, de formarem ímãs permanentes ou serem atraídos por ímãs, são chamados de ferromagnéticos.
Nas condições físico-químicas do planeta Terra, o ferro é bastante versátil, podendo interagir e formar diversos compostos, participar de processos de mobilidades de íons no meio ambiente, formar sólidos, promover reações redox, entre outros. Na maioria dos compostos, o ferro apresenta-se na forma de Fe2+ (íon ferroso) e Fe3+ (íon férrico).
Leia também: Cobalto – elemento que apresenta propriedades magnéticas semelhantes às do ferro
Obtenção do ferro
O ferro é encontrado na natureza principalmente na forma de minérios, os quais costumam ser óxidos, hidróxidos e oxi-hidróxidos, sendo os principais:
-
a hematita (Fe2O3)
-
a goethita (FeOOH)
-
a magnetita (Fe3O4)
Minérios sulfetados de ferro também são comuns, dos quais se destacam principalmente a pirita (FeS2) e a pirrotita (FeS).

No caso da obtenção do ferro metálico de minérios oxigenados, como a hematita, podemos obter este metal de reações de oxirredução com o monóxido de carbono em altas temperaturas.
-
Combustão incompleta do carvão, produzindo monóxido de carbono.
C (s) + ½ O2 (g) → CO (g)
-
Reação do monóxido de carbono com o óxido de ferro (Fe2O3) em um processo redox.
CO (g) + Fe2O3 (s) → 2 FeO (s) + CO2 (g)
-
Redução do FeO a Fe com monóxido de carbono, com formação de CO2.
FeO (s) + CO (g) → Fe (s) + CO2 (g)

O Brasil é um dos maiores produtores de minério de ferro no mundo, e sua produção concentra-se principalmente nos estados de Minas Gerais e Pará. Segundo o Anuário Mineral Brasileiro de 2020, a produção beneficiada de minério de ferro é de cerca de 396 milhões de toneladas, com teor médio de 64% em massa de ferro. A exportação de ferro e seus produtos rendeu cerca de 33 bilhões de dólares aos cofres nacionais no ano de 2019, representando quase 70% do valor obtido com exportações de substâncias metálicas.
Aplicações do ferro
Na indústria e no cotidiano, sem dúvida alguma, a maior utilização do ferro está na produção do aço, uma liga de que este metal é constituinte, agregado ao carbono. O teor de carbono no aço pode variar entre 0,1% e 2% em massa.
O aço é extremamente versátil, muito por conta do tratamento térmico na sua produção e da proporção do carbono, além de apresentar maior dureza e tenacidade que o ferro metálico, garantindo-lhe diversos usos. A influência do ferro é tão grande no desenvolvimento da humanidade, que historiadores denotam o período entre 1200 e 300 a.C como a Era do Ferro.

Do ferro e do aço se fazem utensílios diversos, sejam para a indústria, sejam para uso doméstico. O aço é muito presente na construção civil, sendo utilizado para diminuir o tempo de construção, os materiais utilizados e os custos do empreendimento.
Também é utilizado com o intuito de aumentar a resistência mecânica das estruturas construídas com concreto em relação a fissuras, cargas pontuais e deformações estruturais. O aço também tem ampla utilização na indústria naval, automobilística e de aviação, na construção de estruturas e peças. Para uso doméstico, o aço e o ferro estão presentes em ferramentas, pregos, parafusos, facas, talheres, mobília, panelas, entre outros.
Em processos industriais, o ferro pode também ser utilizado como catalisador, embora não seja a melhor opção frente aos metais nobres paládio e platina, por exemplo. No clássico processo Haber-Bosch, principal método de produção industrial de amônia, o ferro metálico é utilizado como catalisador.
Do ponto de vista biológico, muitos seres vivos dependem do íon Fe2+, já que o centro dos grupos heme, presentes na hemoglobina, é constituído por esse íon. A hemoglobina é responsável pelo transporte de oxigênio dos pulmões aos demais tecidos do corpo, em que ocorre a queima da glicose no processo de respiração celular, essencial para a geração de energia. O transporte só é possível, pois os íons Fe2+ se acoplam com o O2. Ao chegar às células, o oxigênio é trocado pelo CO2, o qual é transportado até os pulmões para ser liberado.
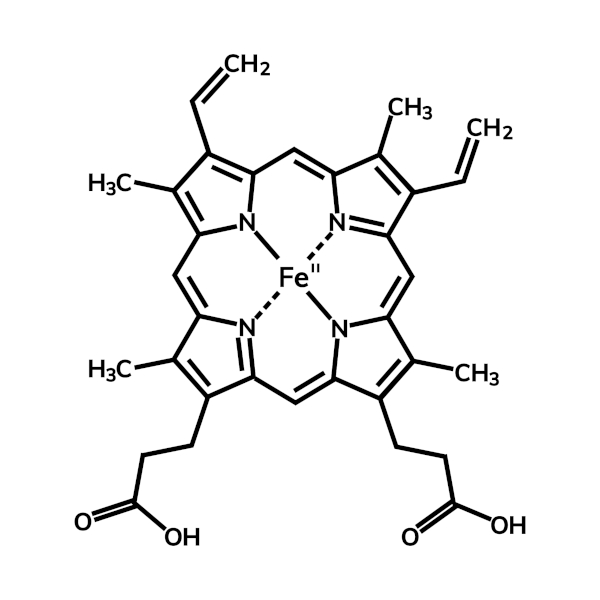
Contudo, deve-se atentar que esse ciclo pode ser afetado pela presença do monóxido de carbono, CO, pois este também pode se combinar com os íons Fe2+. Como consequência, não há transporte de O2 nem troca de CO2, fazendo do CO um gás tóxico, podendo, inclusive, levar à morte os organismos baseados em hemoglobina.
Ainda do ponto de vista biológico, o ferro é praticamente atóxico. Contudo, superdosagens de ferro, transfusões sanguíneas frequentes e alcoolismo crônico podem levar a um grande acúmulo de ferro no corpo, o que pode levar a quadros de vômitos, diarreia e lesões no intestino e demais órgãos. Há também o distúrbio genético de sobrecarga de ferro, chamado de hemocromatose, o qual necessita de tratamento. O ferro pode ser obtido em diversos alimentos animais ou vegetais de nossa dieta, como carnes, espinafre, feijão, leguminosas, nozes, entre outros.
Veja também: Boro – elemento que desempenha importantes funções no metabolismo animal e vegetal
História do ferro
O ferro (palavra que vem do latim ferrum) é utilizado pelo ser humano há milhares de anos, pois já foram identificados artefatos de ferro produzidos em torno de 4000 a 3500 a.C. Na Antiguidade, boa parte do ferro utilizado era de origem meteórica, sendo bastante raro e utilizado apenas em rituais religiosos. As civilizações antigas, por conta dessa origem estelar do ferro, acabaram conferindo-lhe o status de sagrado, reverenciando-o. Os malaios, por exemplo, conservaram por muitos séculos uma bola de ferro.

Esse ferro meteórico era trabalhado com marteladas, sendo possível, assim, modelar objetos desejados, como facas. A siderurgia então se inicia entre 3000 e 2000 a.C, a fim de se obter o metal de seus minérios, provavelmente de forma acidental, quando estes foram aquecidos na presença de carvão vegetal.
Exercícios resolvidos sobre o ferro
Questão 1 - (UERJ 2017) O rompimento da barragem de contenção de uma mineradora em Mariana (MG) acarretou o derramamento de lama contendo resíduos poluentes no rio Doce. Esses resíduos foram gerados na obtenção de um minério composto pelo metal de menor raio atômico do grupo 8 da tabela de classificação periódica. A lama levou 16 dias para atingir o mar, situado a 600 km do local do acidente, deixando um rastro de destruição nesse percurso. Caso alcance o arquipélago de Abrolhos, os recifes de coral dessa região ficarão ameaçados.
O metal que apresenta as características químicas descritas no texto é denominado:
A) Ferro
B) Zinco
C) Sódio
D) Níquel
Resolução
Alternativa A
De acordo com o que está descrito na questão, o elemento pertence ao grupo 8 da tabela de classificação periódica. Ao se observar a Tabela Periódica, vê-se que o ferro (letra A) é o único elemento que pertence ao grupo 8.
Ele também é o de menor raio atômico, uma vez que é o primeiro elemento desse grupo, e, quanto menor o período, menor o número de camadas eletrônicas, sendo assim, menor o raio atômico.
Questão 2 - (UERJ 2017) Considere o processo de dissolução de sulfato ferroso em água, no qual ocorre a dissociação desse sal.
Após esse processo, ao se aplicar um campo elétrico, o seguinte íon salino migrará no sentido do polo positivo:
A) Fe3+
B) Fe2+
C) SO42–
D) SO32–
Resolução
Alternativa C
Sulfato ferroso é a espécie química que possui o ferro com NOx +2, sendo sulfato o ânion derivado do ácido sulfúrico. Assim, o sulfato ferroso é o FeSO4.
Ao ser colocado em água, esse sal sofre a reação de dissociação:
FeSO4 (s) → Fe2+ (aq) + SO42- (aq)
Como queremos saber qual íon migrará no sentido do polo positivo, devemos então entender que será o íon negativo, uma vez que ele será atraído. Assim, a resposta correta é letra C.
Por Stéfano Araújo Novais
Professor de Química

