A eletrólise é um processo muito utilizado pela indústria química, pois ele permite a obtenção de substâncias que não existem livres na natureza, tais como o cloro, o iodo, a soda cáustica, entre outros.
A eletrólise é o oposto da pilha, sendo que nesta última se obtém eletricidade por meio de reações de oxirredução, isto é, transforma-se energia química em energia elétrica. Já na eletrólise, a eletricidade é usada para produzir reações de oxirredução e energia química.
Daí a origem de seu nome, sendo que eletro significa “corrente elétrica” e lise significa “quebra”. É exatamente isso o que ocorre, a corrente elétrica quebra ou decompõe a substância que está sendo submetida a ela.
A pilha é um processo espontâneo, a eletrólise, porém, é um processo não espontâneo, que precisa ser iniciado por meio da corrente elétrica.
Existem dois tipos de eletrólise: a ígnea e a em meio aquoso. Neste texto, trataremos do primeiro caso.
A diferença entre a eletrólise ígnea e a eletrólise em meio aquoso é a forma em que está a substância que será submetida à corrente elétrica. No caso da eletrólise ígnea, a substância iônica está no estado líquido, ou seja, fundida, sem a presença de água. A palavra “ígnea” vem do latim ígneus, que significa “ardente, inflamado”.
Na eletrólise, usa-se um recipiente que é chamado de cuba ou célula eletrolítica, onde são adaptados dois eletrodos por onde passarão a corrente elétrica. Os eletrodos podem ser inertes (não sofrem alteração durante a eletrólise) ou ativos (sofrem algum tipo de alteração durante a eletrólise). Os mais usados são os inertes de platina ou de grafite.
Os eletrodos são, então, ligados a uma fonte de corrente contínua (pilha ou bateria). O polo negativo da bateria irá fornecer elétrons para um dos eletrodos, ficando carregado negativamente e atrairá os cátions (íons positivos) da substância fundida. Devido ao fato de atrair os cátions, esse eletrodo negativo é chamado de cátodo. Nele, os cátions recebem elétrons e se reduzem.
Já o eletrodo positivo atrai os ânions (íons negativos) e, devido a isso, é chamado de ânodo. Os ânions descarregam seus elétrons no ânodo, sofrendo oxidação.
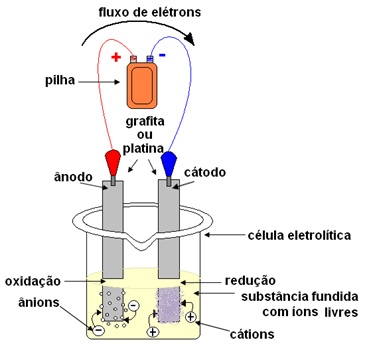
Nas pilhas, o eletrodo positivo é chamado de cátodo e o negativo é o ânodo. Aqui na eletrólise é o contrário, o ânodo é o polo positivo e o cátodo é o polo negativo. No entanto, nos dois casos, na pilha e na eletrólise, no ânodo há a oxidação e no cátodo há a redução.
Resumidamente, temos:

Outro fato importante é que a pilha ou bateria usada para gerar a corrente elétrica deve ter uma ddp (diferença de potencial) igual ou maior que a diferença de potencial da reação.
Para entender melhor como ocorre o processo da eletrólise e como ela decompõe as substâncias produzindo elementos ou substâncias simples importantes, leia o texto Eletrólise Ígnea do Cloreto de Sódio.
Por Jennifer Fogaça
Graduada em Química

