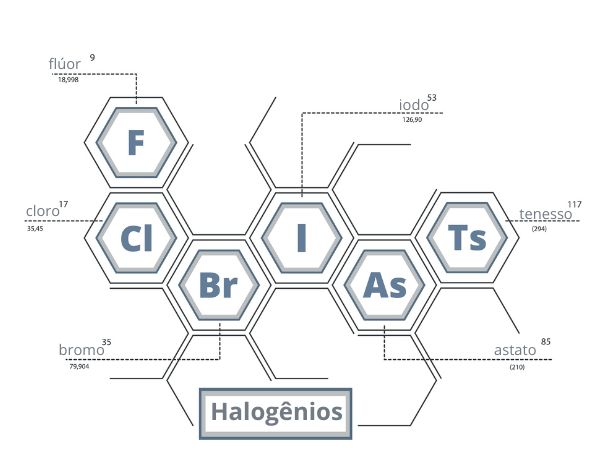
Os halogênios são os elementos do grupo 17 (antigo 7A) da Tabela Periódica: São eles:
- flúor;
- cloro;
- bromo;
- iodo;
- astato;
- tenesso.
Desses, o astato e o tenesso são radioativos e, por isso, são apenas sintetizados em laboratório. O tenesso, inclusive, foi recentemente incluso na Tabela e não há quase nenhuma informação sobre ele. Os halogênios são caracterizados pela alta eletronegatividade, alta afinidade eletrônica e alta energia de ionização.
Os halogênios ocorrem, quando neutros, como substâncias diatômicas (X2) e, com exceção do flúor e astato, podem apresentar estados de oxidação negativo e positivo. Os halogênios têm diversas finalidades, como é o caso do flúor na questão de saúde bucal, e do cloro como desinfetante e alvejante, além de serem importantíssimos na síntese de diversos solventes e produtos orgânicos.
Tópicos deste artigo
- 1 - Resumo sobre os halogênios
- 2 - Quais são os halogênios?
- 3 - Quais são as propriedades dos halogênios?
- 4 - Características dos halogênios
- 5 - Ligações químicas de halogênios
- 6 - Para que serve os halogênios?
- 7 - Exercícios resolvidos sobre halogênios
Resumo sobre os halogênios
- Os halogênios são os elementos pertencentes ao grupo 17 da Tabela Periódica.
- Deles, pouco se sabe acerca do astato (At) e tenesso (Ts), pois seus radioisótopos possuem uma meia-vida muito curta.
- São caracterizados pelas altas eletronegatividade, afinidade eletrônica e energia de ionização.
- São bons oxidantes, com destaque para o flúor, o qual não pode ter número de oxidação positivo.
- Quando neutros, apresentam-se como compostos diatômicos em temperatura ambiente.
- Estão presentes em boa quantidade, tanto na crosta terrestre quanto nos oceanos.
- O flúor é essencial na saúde bucal, pois combate as cáries.
- O cloro é importante na fabricação de alvejantes e desinfetantes.
- O bromo é empregado na fabricação de diversos compostos orgânicos.
- O iodo é empregado como contraste radiológico, além de ser um elemento essencial para nossa saúde.
Quais são os halogênios?
Os halogênios (do grego halos + gen, “formador de sal”) são os elementos pertencentes ao grupo 17 (antigo 7A) da Tabela Periódica. Os elementos, seus símbolos e números atômicos estão listados a seguir:
- flúor (F), Z = 9;
- cloro (Cl), Z = 17;
- bromo (Br), Z = 35;
- iodo (I), Z = 53;
- astato (At), Z = 85;
- tenesso (Ts), Z = 117.
Desses, apenas o tenesso não tem propriedades bem conhecidas ou determinadas, pois foi um elemento recentemente descoberto/sintetizado (em 2009). Seu reconhecimento pela União Internacional de Química e Aplicada foi apenas em 2015, tendo sido posto na Tabela Periódica apenas em 2016. Todos os isótopos do Ts são radioativos, e o seu mais estável possui uma meia-vida inferior a 100 ms (milissegundos).
As propriedades e características elencadas a seguir não envolverão o Ts, dado seu reconhecimento recente.
Quais são as propriedades dos halogênios?
Os halogênios são marcados pelas elevadas energias de ionização, eletronegatividades e afinidades eletrônicas. Isso é consequência do fato dos halogênios estarem a um elétron de terem a mesma configuração eletrônica dos gases nobres, além de experimentarem uma alta atração nuclear por conta da maior carga nuclear efetiva.
O flúor, inclusive, é o elemento com maior eletronegatividade de toda a Tabela Periódica (4,193). Uma consequência direta dessa propriedade é o fato de o flúor não possuir números de oxidação positivos.
O astato é um elemento radioativo e sintético, o que dificulta a obtenção de muitas informações químicas, pois seu radioisótopo mais longevo apresenta tempo de meia-vida de 8,3 horas. A radioatividade do astato é muito intensa e, por isso, é necessário que suas soluções sejam muito diluídas para serem estudadas.
Assim sendo, com exceção do flúor e astato, os demais halogênios (cloro, bromo e iodo) podem apresentar estados de oxidação que vão do -1 ao +7 (mais especificamente -1, +1, +3, +5 e +7).
Os halogênios (F, Cl, Br e I) são extremamente reativos. Isso impacta diretamente na forma como eles são encontrados na natureza: como são muito reativos, estão sempre associados a outros átomos. Uma característica marcante dessa reatividade elevada está no fato de os halogênios serem excelentes oxidantes, sendo o F2 o mais oxidante de todos os elementos e o I2, ainda que um bom oxidante, o mais fraco de todos os halogênios.

Todos os halogênios neutros são diatômicos em temperatura ambiente e prontamente reduzidos para íons haleto (X-). Reagem com o hidrogênio para formar gases que, com exceção do HF, comportam-se como ácidos fortes quando dissolvidos em água.
As temperaturas de fusão e ebulição dos halogênios crescem de acordo com seu tamanho, o que está de acordo com o aumento das forças de Van der Waals (ou London):
|
Composto |
Ponto de fusão (°C) |
Ponto de ebulição (°C) |
|
F2 |
-218,6 |
-188,1 |
|
Cl2 |
-101,0 |
-34,0 |
|
Br2 |
-7,25 |
59,5 |
|
I2 |
113,6a |
185,2 |
|
At2 |
302 |
- a sublima-se prontamente.
- b valores aproximados.
Características dos halogênios
Como mencionado, os halogênios neutros se apresentam como moléculas diatômicas. O flúor se apresenta como um gás em temperatura ambiente, com fórmula F2. É extremamente reativo e deve ser manuseado com técnicas adequadas.

Já o cloro (Cl2) é um gás amarelo esverdeado e tem um odor que remete ao alvejante. O Br2 é um líquido castanho que evapora com facilidade, enquanto o iodo (I2) é um sólido preto, lustroso, facilmente sublimável em temperatura ambiente, produzindo um vapor roxo.

Os halogênios estão presentes na faixa de poucos ppb (parte por bilhão) na crosta terrestre e nos oceanos. O flúor é mais facilmente encontrado em minerais, como a fluorita (CaF2), criolita (Na3[AlF6]) e fluorapatita (Ca5F(PO4)3). O cloro está intimamente ligado ao sódio e ao potássio, como na sal-gema (NaCl), silvita (KCl) e carnalita (KCl∙MgCl2∙6H2O). A água do mar é uma fonte de Br2, mas concentrações mais significativas de íons brometo (Br-) são encontradas em lagos salgados e poços de salmouras naturais.
De todos os halogênios que ocorrem naturalmente, o iodo é o menos abundante. Ocorre na forma de íon iodeto (I-) nos oceanos, sendo absorvido pelas algas marinhas (das quais é possível extraí-lo).
O astato, devido a seus radioisótopos terem meia-vida curta, não é encontrado na natureza em quantidades apreciáveis. Contudo, traços desse elemento podem ser detectados como produtos intermediários do decaimento de elementos radioativos, como no decaimento do 218Po.
Leia também: Calcogênios — os elementos do grupo 16 da Tabela Periódica
Ligações químicas de halogênios
Os halogênios, como ametais, realizam ligações covalentes. Destaca-se, entretanto, alguns comportamentos do elemento flúor.
Quando o flúor se liga a outro elemento químico (X), a ligação X–F é mais forte que a ligação X–Cl correspondente, o que é ainda intensificado se X for um átomo que não possua pares de elétrons não ligantes. Isso devido ao pequeno tamanho do átomo de flúor e de sua alta eletronegatividade.
Outra coisa que chama a atenção no flúor é baixa energia de dissociação, ou seja, é necessária pouca energia para separar os átomos de flúor no F2. Isso impacta significativamente na alta reatividade do flúor. Era esperado que, por ser um átomo menor, o flúor tivesse uma alta energia de dissociação, já que a distância interatômica é a menor entre todos os halogênios (143 pm).
Contudo, percebe-se que a ligação F–F é tão fraca quanto a ligação I–I, uma molécula cuja distância interatômica é de 266 pm. Para se ter noção, são necessários 158,8 kJ para dissociar 1 mol de moléculas F2, enquanto são necessários 151,1 kJ para dissociar 1 mol de moléculas I2.
A fraqueza da ligação F–F pode ser explicada pela presença dos elétrons não ligantes no F2, que causam uma grande repulsão eletrônica, visto o pequeno volume molecular. Essa repulsão, inclusive, aumenta a distância entre os átomos de flúor no F2. Modelos matemáticos apontam que o esperado era uma distância interatômica de 128 pm e não de 143 pm.
Para que serve os halogênios?
A indústria de combustível nuclear utiliza grandes quantidades de F2 na produção do UF6 para o enriquecimento de urânio combustível. O HF, o BF3 e o CaF2 são produtos de flúor muito usados na indústria, bem como os clorofluorcarbonos (CFCs).
Nas estações de tratamento de água de diversos países (como no Brasil), o cloro e o flúor são adicionados na etapa de tratamento. O cloro tem função bactericida, enquanto o flúor tem função de diminuir surtos de cárie na população. Mesmo assim, os cremes dentais são comumente fabricados com fluoreto de sódio (NaF) ou monofluorfosfato de sódio.
O cloro é muito empregado na fabricação de monômeros, como o cloreto de vinila (usado na fabricação do PVC) e o 1,2-dicloroetetno. O ClO2, dióxido de cloro, é utilizado como alvejante/branqueador na indústria de papel e celulose. Anteriormente, tal função era feita pelo próprio Cl2, mas questões ambientais o fizeram ser substituído pelo dióxido de cloro. O cloro também é importante na preparação de solventes, como o ácido clorídrico (muriático), e desinfetantes, como a água sanitária.

Bromo e iodo são empregados majoritariamente na confecção de compostos orgânicos em que eles estejam na composição final. Outros usos envolvem a utilização do iodeto de potássio e do brometo de prata na indústria fotográfica (embora tenha diminuído com o avanço de câmeras digitais). O bromo também está presente em substâncias chamadas de “retardantes de chama”, as quais retardam ou eliminam a ignição de materiais.
O iodo, ainda, é utilizado como contraste em exames radiológicos e é essencial para nossa vida. A Organização Mundial da Saúde ordena a adição de iodo ao sal de cozinha, de modo a conter o surto de bócio (causado pela deficiência de iodo).
Exercícios resolvidos sobre halogênios
Questão 1
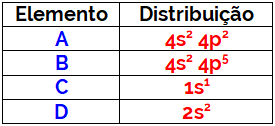
(Uerj) O ânion do ácido produzido no estômago corresponde ao elemento químico pertencente ao grupo 17 e ao terceiro período da tabela de classificação periódica.
Esse ácido é denominado:
a) nítrico
b) sulfúrico
c) clorídrico
d) fluorídrico
Resposta: Letra C
Sendo do grupo 17, trata-se de um halogênio. O halogênio do terceiro período é o cloro e, assim, seu ânion é o cloreto (Cl-). Na forma de ácido, ele está como HCl, cujo nome é ácido clorídrico.
Questão 2
(Fatec SP) Cloro, bromo e iodo são elementos químicos classificados como halogênios. Logo, eles
a) localizam-se no mesmo grupo (ou família) da Tabela Periódica.
b) estão no mesmo período da Tabela Periódica.
c) possuem o mesmo número atômico.
d) apresentam mesma eletronegatividade.
e) são isótopos entre si.
Resposta: Letra A
Os halogênios são os elementos do grupo 17 da Tabela Periódica. Assim, sendo todos halogênios, todos pertencem ao mesmo grupo.
Por Stéfano Araújo Novais
Professor de Química