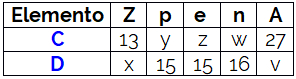
O número atômico (Z) e o número de massa (A) são essenciais para a caracterização da espécie atômica. Enquanto o número atômico representa a carga nuclear do átomo, sendo numericamente igual ao número de prótons no núcleo, o número de massa corresponde ao somatório de prótons e nêutrons, que são as partículas subatômicas essenciais para a determinação da massa.
O número atômico serve para identificar a qual elemento químico a espécie atômica pertence. Assim, átomos distintos com mesmo número de prótons, além de serem isótopos, pertencem ao mesmo elemento químico. Já o número de massa pode ser diferente entre átomos do mesmo elemento químico e igual para átomos de elementos distintos. Quando espécies atômicas diferentes possuem o mesmo número de massa, elas são chamadas de isóbaros.
Leia também: Quais são as partículas da estrutura de um átomo?
Tópicos deste artigo
- 1 - Resumo sobre número atômico (Z) e número de massa (A)
- 2 - O que é número atômico e número de massa?
- 3 - Quais as diferenças entre número atômico e o número de massa?
- 4 - Como descobrir número atômico e número de massa?
- 5 - Exercícios resolvidos sobre número atômico e número de massa
Resumo sobre número atômico (Z) e número de massa (A)
- O número atômico (Z) e o número de massa (A) são duas grandezas importantes para a caracterização das espécies atômicas.
- O número atômico é numericamente igual ao número de prótons, representando a carga nuclear do átomo.
- O número de massa é igual ao somatório de prótons e nêutrons, as duas partículas subatômicas com massas significativas.
- O número atômico é utilizado para identificar a qual elemento químico a espécie atômica pertence.
- O número de massa não possui caráter de identificação da espécie, podendo, inclusive, ser diferente para espécies atômicas do mesmo elemento, ou igual para espécies de elementos distintos.
O que é número atômico e número de massa?
O número atômico, expresso pela letra Z, consiste na carga nuclear de uma espécie atômica, sendo, assim, numericamente igual ao número de prótons presentes no núcleo da referida espécie.
Z = nº de prótons
Já o número de massa, expresso pela letra A, consiste em uma medida da massa da espécie atômica, a qual leva em consideração apenas o número de prótons e nêutrons da referida espécie.
A = p + n ou A = Z + n
O número de elétrons é descartado para o cálculo do número de massa, uma vez que a massa de um elétron é cerca de 1836 vezes menor que a massa de um próton ou de um nêutron.
Quais as diferenças entre número atômico e o número de massa?
O número atômico apresenta o número de cargas positivas presentes no átomo, ou seja, a quantidade de prótons presentes no núcleo atômico. Além disso, o número atômico é utilizado para identificar a qual elemento químico pertence a espécie atômica analisada. Dessa forma, os elementos químicos são distinguidos pelos seus respectivos números atômicos. Átomos que possuem o mesmo número atômico são chamados de isótopos. Na literatura, é comum representar o número atômico embaixo, à esquerda: ZX.
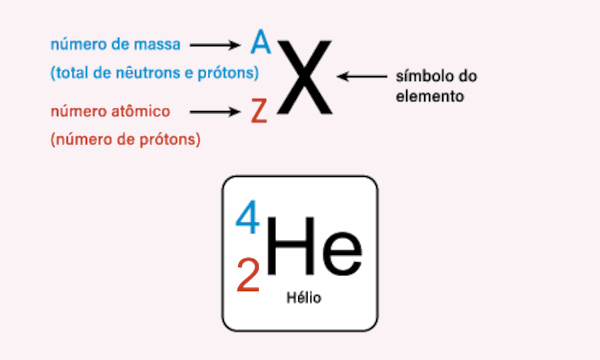
Já o número de massa é o somatório das partículas subatômicas que são significativas para a massa da espécie atômica, no caso, prótons e nêutrons. Não é uma medida para distinção dos elementos químicos, tanto que elementos químicos distintos podem ter o mesmo número de massa. Espécies atômicas que possuem mesmo número de massa são chamadas de isóbaros. Na literatura, é comum representar o número de massa em cima, à esquerda: AX.
Veja no quadro um resumo dessas diferenças:
|
|
Número atômico (Z) |
Número de massa (A) |
|
Definição |
Expressa a carga nuclear de uma espécie atômica |
Expressa a massa de uma espécie atômica |
|
Método de determinação |
Numericamente igual ao número de prótons no núcleo |
Somatório dos prótons e nêutrons de um átomo |
|
Função |
Identifica a qual elemento químico a espécie atômica corresponde |
Apresenta a massa da espécie atômica |
|
Representação |
Embaixo, à esquerda. |
Em cima, à esquerda |
|
Nome dado a espécies atômicas diferentes que apresentam o mesmo valor. |
Isótopos |
Isóbaros |
Como descobrir número atômico e número de massa?
O número atômico é diretamente determinado pelo número de prótons da espécie atômica. Contudo, caso isso não seja possível, pode-se utilizar as seguintes alternativas:
1. Através do número de elétrons, uma vez que os átomos são eletricamente neutros e, para cada elétron existente, há um próton correspondente.
2. No caso de íons, onde o número de elétrons não é o mesmo de prótons, deve-se corrigir pela carga. Por exemplo, se um cátion de carga +2 possui 28 elétrons, é porque o átomo possui 30 prótons. Se um ânion de carga -2 possui 10 elétrons, é porque o átomo possui 8 prótons.
3. Através do número de massa e do número de nêutrons, isolando-se o valor de prótons/número atômico na expressão A = Z + n. Por exemplo, se um átomo possui A = 23 e n = 12, então o número atômico é igual a 11.

Já para número de massa, a determinação deve ocorrer por meio da expressão A = Z + n. Dessa forma, é importante que se saiba o número de prótons e nêutrons para sua determinação.
Por exemplo: uma espécie atômica hipotética possui 26 prótons e 30 nêutrons, sendo assim, determine seu número de massa:
A = Z + n
A = 26 + 30
A = 56
Assim, conclui-se que a espécie atômica hipotética possui número de massa igual a 56.
Saiba mais: O que é a massa atômica?
Exercícios resolvidos sobre número atômico e número de massa
Questão 1. (ETEC/2025.1) Leia o texto para responder à questão.
A organização não governamental World Wide Fund for Nature (WWF) elaborou um relatório no qual listou vários “superalimentos do futuro”. Nessa lista, destaca-se a planta moringa (Moringa oleífera), também conhecida em algumas culturas como “acácia-branca” ou “árvore-da-vida” devido a suas propriedades antivirais, anti-inflamatórias, antidepressivas e antifúngicas.
Suas folhas são ricas em proteínas, aminoácidos, vitaminas A e C, além de possuírem elevado teor de minerais como cálcio, potássio, fósforo, magnésio e ferro. Alguns desses minerais não só fortalecem ossos e dentes, como também colaboram na contração muscular. Possuem também muitas fibras que ajudam na atividade intestinal e mantêm a sensação de saciedade.
Dentro de suas longas vagens, ficam as sementes, que, quando trituradas e adicionadas à água barrenta, têm a capacidade de atrair impurezas, atuando como um agente purificador natural. Essas sementes são ricas em ácido oleico, que tem sido associado aos níveis elevados de colesterol “bom” no corpo.
https://tinyurl.com/486r4fux Acesso em: 18.07.2024. Adaptado.
Considerando os dados dos elementos químicos encontrados nas folhas da planta moringa, assinale a alternativa correta.
![]()
A) O cálcio apresenta 20 nêutrons.
B) O ferro apresenta número atômico 56.
C) O potássio apresenta número atômico 15.
D) O elemento de menor número de massa é o fósforo.
E) O elemento com maior número de nêutrons é o magnésio.
Resposta: Letra A.
Pelos dados apresentados, o cálcio (Ca), apresenta A = 40 e Z = 20. Dessa forma, seu número de nêutrons pode ser determinado pela expressão:
A = Z + n
40 = 20 + n
n = 20.
Questão 2. (USS – Univassouras Medicina/2025)
A castanha do Pará é um dos principais alimentos ricos em selênio, um estimulante do sistema imunológico.
O principal isótopo desse elemento presente na castanha é o 80Se.
A quantidade de nêutrons presente nesse isótopo é igual a:
A) 35
B) 46
C) 58
D) 67
Resposta: Letra B.
O selênio é o elemento químico de número atômico 34. O referido isótopo apresenta A = 80. Assim, o número de nêutrons é determinado pela expressão:
A = Z + n
80 = 34 + n
n = 46
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: https://goldbook.iupac.org/