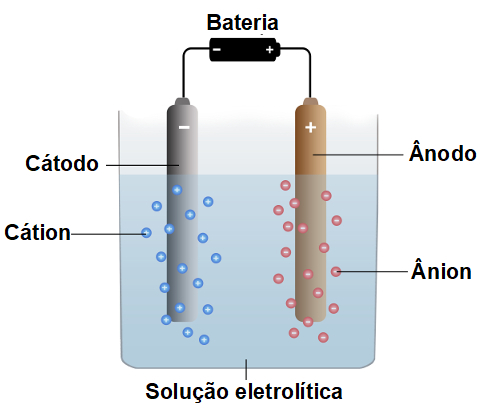
Eletrólise é um processo não espontâneo, isto é, que não ocorre naturalmente, em que se formam substâncias por meio de descarga elétrica em compostos fundidos ou dissolvidos em água. Nesse processo, uma corrente elétrica chega até um recipiente de vidro (cuba eletrolítica) que possui dois eletrodos inertes (que não sofrem nem oxidação nem redução) formados por grafita ou platina. Esses eletrodos estão conectados a uma fonte elétrica (geralmente uma bateria) e mergulhados em um sal ou uma base fundida ou dissolvida em água. Assim como a pilha, a eletrólise apresenta um cátodo (onde ocorre a redução) e um ânodo (onde ocorre a oxidação).
Tópicos deste artigo
- 1 - Resumo
- 2 - Tipos de eletrólise
- 3 - Descarga seletiva de íons
- 4 - Eletrólise da água
- 5 - Aplicações da eletrólise
- 6 - Exercícios resolvidos sobre eletrólise
Resumo
-
Eletrólise é um processo não espontâneo;
-
Podem ser formadas substâncias simples ou compostas;
-
Pode ocorrer com um soluto fundido (eletrólise ígnea);
-
Pode ocorrer com um soluto dissolvido em água (eletrólise aquosa);
-
Um cátion sempre sofre redução no cátodo;
-
Um ânion sempre sofre oxidação no ânodo.
Não pare agora... Tem mais depois da publicidade ;)
Veja também: Obtenção de alumínio a partir da eletrólise
Tipos de eletrólise
→ Eletrólise ígnea
É uma eletrólise que ocorre quando a descarga elétrica é realizada sobre um composto iônico fundido. O composto iônico é aquele formado por ligação iônica, como um sal ou uma base inorgânica. Quando falamos em composto fundido, por sua vez, referimo-nos ao composto que passa do estado sólido para o estado líquido.
- Exemplo de eletrólise ígnea
Quando realizamos a fusão do cloreto de potássio (KCl), esse sal sofre o processo de dissociação, liberando o cátion potássio (K+) e o ânion iodeto (l-).
![]()
Equação de dissociação do cloreto de potássio
Quando a corrente elétrica chega à cuba eletrolítica com esses íons, o cátion potássio sofre redução, formando potássio metálico (K), e o ânion iodeto sofre oxidação, formando o iodo sólido (I2).
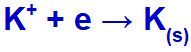
Equação de formação do potássio sólido
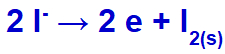
Equação de formação do iodo sólido
→ Eletrólise aquosa
É uma eletrólise que ocorre quando a descarga elétrica é realizada sobre uma solução aquosa (possui água) formada por um sal ou uma base inorgânica.
- Exemplo de eletrólise aquosa
Quando dissolvemos o cloreto de sódio em água, ele sofre dissociação, e a água sofre ionização:
.jpg)
Equações de ionização da água e dissociação do cloreto de sódio
Como o cátion sódio (Na+) pertence à família IA, o cátion hidrônio (H+) passa pela descarga e sofre redução, formando o gás hidrogênio (H2).
.jpg)
Equação de formação do gás hidrogênio
Como o cloreto (Cl-) não é oxigenado (não possui oxigênio) e não é o fluoreto (F-), ele sofre descarga, oxidando-se e formando o gás cloro (Cl2).

Equação de formação do gás cloro
Descarga seletiva de íons
Durante um processo de eletrólise em meio aquoso (solução formada por água e um soluto), sempre teremos dois cátions: o hidrônio, proveniente da água, e um outro qualquer, proveniente da dissociação do sal (um exemplo de soluto). Também teremos dois ânions: a hidroxila, proveniente da água, e um outro qualquer, proveniente do sal.

Íons provenientes da ionização da água e da dissociação do sal
- Descarga seletiva para cátions e ânions
-
Se o cátion proveniente do soluto pertencer à família IA, IIA ou IIIA, o hidrônio (H+) sofrerá redução;
-
Se o cátion proveniente do soluto não pertencer às famílias citadas acima, ele sofrerá a redução.
-
Se o ânion proveniente do soluto apresentar oxigênio em sua composição ou for um fluoreto (F-), o hidróxido (OH-) sofrerá a oxidação;
-
Se o ânion proveniente do soluto não apresentar as características acima, ele sofrerá a oxidação.
Não pare agora... Tem mais depois da publicidade ;)
Eletrólise da água
Sabe-se que a água apresenta a capacidade de se autoionizar, produzindo os íons hidrônio (H+) e hidróxido (OH-), mas essa ionização é bem limitada. Esse fato é comprovado pela ineficiência da água pura em conduzir corrente elétrica.
Como a eletrólise envolve descarga elétrica, para realizar a eletrólise da água, é necessária a dissolução de um soluto, o qual favorece a descarga seletiva do hidrônio e do hidróxido (como foi visto no tópico sobre descarga seletiva).
Se adicionarmos na água o sulfato de sódio (Na2SO4), por exemplo, teremos no meio os cátions sódio (Na+) e hidrônio (H+), bem como os ânions hidróxido (OH-) e sulfato (SO4-2). Assim, quando a corrente elétrica chegar na cuba eletrolítica:
-
o hidrônio sofrerá descarga, reduzindo-se, pelo fato de o sódio pertencer à família IA;
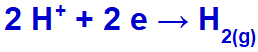
Equação de formação do gás hidrogênio
-
o hidróxido sofrerá descarga, oxidando-se, pelo fato de o sulfato apresentar oxigênio em sua composição.
Não pare agora... Tem mais depois da publicidade ;)
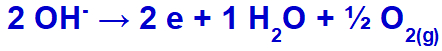
Equação de formação do gás oxigênio
Como os dois íons (cátion e ânion) provenientes da água sofreram descarga, dizemos que ocorreu a eletrólise da água.
Veja também: Aspectos quantitativos da eletrólise
Aplicações da eletrólise
-
Produção de substâncias simples, como o gás hidrogênio (H2), gás oxigênio (O2) etc.;
-
Produção de substâncias compostas, como o hidróxido de sódio (NaOH), ácido sulfúrico (H2SO4) etc;
-
Revestimento de uma peça com um determinado metal, como o cobre (cobreação) e o ouro (banho de ouro);
Não pare agora... Tem mais depois da publicidade ;) -
Utilização para retirar um determinado metal do seu minério.
Exercícios resolvidos sobre eletrólise
Exemplo 1 - (Vunesp) Uma solução aquosa de CuCℓ2 é submetida a uma eletrólise, utilizando-se eletrodos de platina. A afirmação correta é:
a) No cátodo ocorre redução do íon Cu2+.
b) No ânodo ocorre oxidação do íon Cu2+.
c) No cátodo ocorre formação de cloro gasoso.
d) Parte do ânodo de platina dissolve-se, formando Pt2+.
e) Os produtos dessa eletrólise seriam diferentes se a eletrólise do CuCl2 fosse ígnea (fusão).
a) Correta. Quando o CuCl2 é dissolvido em água, passamos a ter os cátions hidrônio (H+) e cobre II (Cu+2). Como o cátion cobre II não pertence às famílias IA, IIA e IIIA, ele sofre redução.
b) Falso, pois no ânodo ocorre a oxidação do ânion cloreto (Cl-), o qual não apresenta oxigênio em sua composição e não é o fluoreto (F-).
c) Falso, pois no cátodo ocorre a redução do cátion cobre II, logo, há a formação do metal cobre.
d) Falso, pois eletrodos de platina ou grafita na eletrólise apenas conduzem a eletricidade, não participam do processo.
e) Falso, pois a eletrólise ígnea do cloreto de cobre II (CuCl2) apresentaria exatamente os mesmos produtos da aquosa, pois os íons presentes seriam o cobre II (Cu+2) e o cloreto (Cl-1).
Exemplo 2- (UFRN) Considere os seguintes sistemas:
I. Cloreto de sódio fundido;
II. Solução aquosa de cloreto de sódio;
III. Hidróxido de sódio fundido;
IV. Solução aquosa de hidróxido de sódio.
Os que podem fornecer sódio, quando submetidos à eletrólise, são:
a) apenas I e II.
b) apenas I e III.
c) apenas II e IV.
d) apenas III e IV.
e) I, II, III e IV.
Os sistemas que fornecem sódio metálico como produto no cátodo são o I e III.
I- O único cátion presente no meio é o cátion sódio, logo, apenas ele pode reduzir, formando sódio metálico.
II- Esse sistema não fornece sódio metálico porque o cloreto de sódio foi dissolvido em água, logo, no meio temos a presença dos cátions sódio (Na+) e hidrônio (H+) - este que é quem sofre a redução, pois o sódio é da família IA.
III- O único cátion presente no meio é o cátion sódio (pelo fato de o material ter sido submetido a uma fusão), logo, apenas ele sofrer redução, formando sódio metálico;
IV- Esse sistema não fornece sódio metálico porque o hidróxido de sódio foi dissolvido em água, logo, no meio temos a presença dos cátions sódio (Na+) e hidrônio (H+) - este que é quem sofre a redução, pois o sódio é da família IA.
Por Me. Diogo Lopes Dias